Questões de Vestibular
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 380 questões
Considerando as semirreações
BiO3- + 6H+ + 2e- → Bi3+ + 3H2O e Mn2+ + 4H2O → MnO4- + 8H+ + 5e- , é correto afirmar que o coeficiente do íon MnO4- na reação global devidamente balanceada é
A coniina é um alcaloide venenoso. Suas propriedades tóxicas eram conhecidas desde a antiguidade e já eram usadas na época dos gregos como um veneno para ser administrado àqueles condenados à morte.
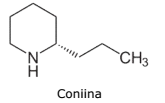
Atente ao que se diz a seguir sobre essa substância:
I. Contém carbono terciário.
II. É um composto aromático.
III. É um composto nitrogenado heterocíclico.
IV. Tem fórmula molecular C8H17N.
Está correto o que se afirma somente em
A nitroglicerina - C3H5(NO3)3 – é um nitrato de alquila, descoberta em 1847 por Ascanio Sobrero (químico italiano, 1812-1888), que a obteve misturando glicerina, ácido nítrico e ácido sulfúrico. No estado puro e à temperatura ambiente, a nitroglicerina é um líquido muito explosivo e perigoso. Em 1867, Alfred Nobel (químico sueco, 1833-1896) realizou testes no sentido de melhorar a manipulação da nitroglicerina, misturando-a com materiais inertes, como sílica, pós cerâmicos, argila, gesso, carvão e terras diatomáceas. Esses materiais, agora moldáveis, viriam a se tornar um explosivo muito importante, conhecido como dinamite.
A equação abaixo (não balanceada) representa a reação de decomposição da nitroglicerina:
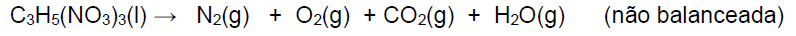
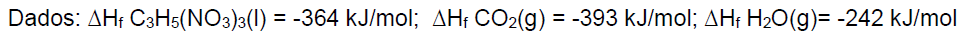
De posse das informações, assinale a alternativa que representa a variação de entalpia da
reação acima, em kJ por mol de nitroglicerina.
Em 1915, o exército alemão utilizou, pela primeira vez, bombas de gás cloro contra trincheiras francesas e argelinas, causando a morte em mais de 5 mil soldados. O cloro gasoso pode ser utilizado na fabricação de solventes clorados, inseticidas (DDT), purificação de água, produção de compostos inorgânicos como hipoclorito de sódio (NaOCl), cloretos metálicos. Uma forma de produzir cloro gasoso em pequenas quantidades é pela reação entre permanganato de potássio e ácido clorídrico, apresentada a seguir:
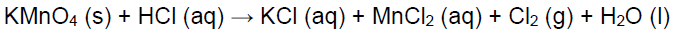
Sobre essa reação, analise as proposições.
I. Trata-se de uma reação de oxirredução, em que o cloreto sofre oxidação e o manganês sofre redução.
II. A reação está balanceada.
III. A reação não está balanceada, sendo os coeficientes estequiométricos para essa reação 2:16:2:2:5:8.
IV. O estado de oxidação do átomo de manganês passa de 7+ para 2+, nessa reação, tratando-se de uma redução.
V. O cloreto é o agente redutor nesta reação.
Assinale a alternativa correta.
Considere as informações a seguir sobre a perfluorodecalina, substância utilizada no preparo de sangue artificial.
Fórmula mínima: C5 F9 .
Massa molar: 462 g/mol.
Sua fórmula molecular é representada por:
Dois elementos genéricos X e Y apresentam as seguintes distribuições eletrônicas por camadas: X(2, 8, 8, 1) e Y(2, 8, 18, 6). Considerando-se uma provável ligação química entre esses elementos (X e Y), afirma-se:
I O átomo X ganha 1 elétron e transforma-se em um cátion monovalente.
II A fórmula do composto formado é X2Y.
III A ligação que ocorre entre eles é do tipo iônica.
IV O átomo Y cede 2 elétrons e transforma-se em um ânion bivalente.
São corretas apenas as afirmações:
O cloreto de cobalto(II) anidro, CoCℓ2 , é um sal de cor azul, que pode ser utilizado como indicador de umidade, pois torna-se rosa em presença de água. Obtém-se esse sal pelo aquecimento do cloreto de cobalto(II) hexa-hidratado, CoCℓ2 .6H2O, de cor rosa, com liberação de vapor de água.
sal hexa-hidratado (rosa)  sal anidro (azul) + vapor de água
sal anidro (azul) + vapor de água
A massa de sal anidro obtida pela desidratação completa de 0,1 mol de sal hidratado é, aproximadamente,
Para demonstrar a aplicação dessas leis, um professor apresentou uma reação do tipo A + B → C + D e solicitou aos alunos que encontrassem os valores que deveriam substituir as letras x, y e z na tabela.
REAÇÃO A B C D 1º experimento 12 g 25 g x 17 g 2º experimento 30 g y 50 g z
Baseando-se nas leis mencionadas, os valores corretos obtidos pelos alunos foram
Considere a reação abaixo (não balanceada):
NH3 + O2 ➔ NO + H2O
O número de moléculas de NO formadas na reação da amônia (NH3) com 2,0 .1021 moléculas de oxigênio será:
Considere a equação química (não balanceada) para a combustão do etanol:
C2H6O(l) + O2(g) ➜ CO2(g) + H2O(l)
Dados: Entalpia de formação de C2H6O(l) = – 66 kcal/mol
Entalpia de formação de CO2(g) = – 94 kcal/mol
Entalpia de formação de H2O(l) = – 68 kcal/mol
A entalpia de combustão em kcal/mol será:
Fe2O3 + C →Fe + CO
(Dados: Massa molar do Fe2O3 = 160 g/mol; Massa molar do Fe = 56 g/mol) Quantos quilogramas de hematita são necessários para produzir 560 kg de Fe?
Supondo que 1 mol de NaOH reage com 1 mol de HCl e, levando-se em consideração a lei de conservação das massas de Lavoisier, quantos gramas de H2O seriam produzidos nesta reação?
A reação (não balanceada) dos íons permanganato com íons iodeto em meio alcalino pode ser representada por:
I-(aq) + MnO4-(aq) + H2O I2(aq) + MnO2(s) + OH-(aq)
Uma vez balanceada, a soma dos menores coeficientes estequiométricos inteiros dos reagentes é:
NaN3 (s) → N2 (g) + Na (s)
Quando se acertam os coeficientes estequiométricos, usando o menor conjunto adequado de coeficientes inteiros, a soma dos coeficientes é
Câmara aprova liberação da produção e venda de remédios para emagrecer. Folha de São Paulo, 11 de set. de 2017. Seção Equilíbrio e Saúde. Disponível em:<http://www1.folha.uol.com.br/equilibrioesaude/2017/06/1894411-camara-aprovaliberacao-da-roducao-e-venda-de-emedios-para-emagrecer.shtml> . Acesso em: 07 set. 2017. Adaptado.
Analisando o texto e a estrutura da molécula da sibutramina (figura 1), marque a alternativa CORRETA.
