Questões de Vestibular
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 380 questões
I. A pólvora negra é uma mistura de carvão vegetal, nitrato de potássio e enxofre em que predominam substâncias representadas, respectivamente, por: C, KNO3 e S.
II. A neutralização do hidróxido de amônio é representada por: NH4 Cl(s) + H2 O(l) → NH4 + (aq) + OH- (aq) + H+ (aq) + Cl- (aq).
III. A combustão de uma porção de palha de aço é representada pela seguinte equação: 2 Fe(s) + O2(g) → 2 FeO(s)
IV. Os elementos químicos do terceiro período da tabela periódica − que estão, respectivamente, no segundo e terceiro grupos − são representados por: Mg e Al.
De acordo com as informações acima, são corretas apenas as afirmativas
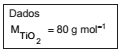
O titânio é obtido a partir do mineral rutilo (TiO2 ) em duas etapas: a primeira, formando cloreto de titânio a 1000 °C (Equação I); e a segunda, usando magnésio para promover a redução e obter o titânio (Equação II).
TiO2(s) + 2 C(s) + 2 Cl2(g) → TiCl4(g) + 2CO(g) (Equação I)
TiCl4(l) + 2 Mg(s) → Ti(s) + 2 MgCl2(l) (Equação II)
Considere que 6,0 ton de minério produziram massa igual a 2,4 ton de Ti, considerando as reações completas. A porcentagem (valor arredondado mais próximo) de TiO2 originalmente no minério é:
Uma forma de se obter oxigênio em laboratório é pela reação química entre solução aquosa de peróxido de hidrogênio (água oxigenada) e solução aquosa de permanganato de potássio em meio ácido, cuja equação, parcialmente balanceada, é:
xKMnO4(aq) + 3H2SO4(aq) + yH2O2(aq)→
→ K2SO4(aq) + 2MnSO4(aq) + zO2(g) + 8H2O(l)
Nessa equação, os valores dos coeficientes estequiométricos x, y e z são, respectivamente,
O sal iodado é aquele onde foi adicionado iodo, ou na forma de IODETO(iodetado), normalmente iodeto de potássio, ou na forma de IODATO(iodatado), normalmente iodato de potássio.

O iodo serve para prevenir distúrbios causados pela supressão deste elemento de nossa alimentação, os chamados DDIs.
DDIs (Distúrbios por Deficiência de Iodo) são problemas de saúde, tais como: o bócio, abortos prematuros, retardos mentais, etc. Para consumo humano, é considerada adequada, para um adulto, a ingestão de 0,15 mg de iodo por dia.
Assinale a opção que contém a fórmula do iodeto de potássio e do iodato de potássio, respectivamente.
A aspirina, ou ÁCIDO ACETIL SALISILICO –AAS, é, talvez, o analgésico mais utilizado em todo o mundo.Dentre as opções abaixo, que fórmula representa este importante fármaco?

Antigamente,o lança-perfume era a coqueluche dos salões -até mesmo as crianças ganhavam tubinhos para se divertirem nos bailes. Hoje em dia,é considerado entorpecente pela vigilância sanitária, e seu uso no Brasil é crime. Com fabricação proibida no Brasil, ele aparece por ocasião do carnaval, contrabandeado de outros países sul-americanos, como Argentina , Paraguai , Uruguai, países onde seu consumo não é considerado crime.Dos componentes do lança perfume, os mais comuns são o éter etílico e o clorofórmio (triclorometano). Escolha a opção abaixo que contém as fórmulas destas duas substâncias.

“A forma como o lança-perfume “turbinado” vem sendo consumido, jogado diretamente na boca – e não inalado, como o produto tradicional – pode causar a morte em poucos segundos, alertam médicos especialistas em dependência química...” (Diego Zanchetta, em O Estado de São Paulo, abril de 2015. Disponível em: http://sao-paulo.estadao.com.br/noticias/geral,lanca-perfumeturbinado-e-vendido-livremente-na-frente-de-baladas-em-sao-paulo,1672343. Acessado em 23/08/2015).
O lança perfume é um mistura de solventes inalantes prejudiciais à saúde. Sua formulação mais recente, chamada de “turbinada” pelos trafi cantes, contém haletos orgânicos voláteis de uso industrial. Estes novos componentes são utilizados, por exemplo, na remoção de adesivos e como anti-respingo de solda e já provocaram a morte de vários usuários este ano. A fórmula de um composto utilizado na fabricação do lança-perfume “turbinado” é apresentada em:
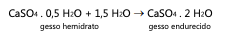
O conhecimento do processo químico de endurecimento do gesso permite avaliar possíveis alterações em sua massa. De fato, a equação química apresentada permite constatar que, após seu preparo, aplicação e endurecimento, o gesso apresenta:
Dados: massas moleculares (g/mol): H = 1, O = 16, S = 32, Ca = 40.
a Cd(NO3)2(aq) + b Na2S(aq) → x CdS(s) + y NaNO3(aq)
Após o balanceamento, a soma dos valores dos coeficientes estequiométricos a, b, x e y é:
x Au(s) + y NO3− (aq) + w H+ (aq) + z Cl− (aq) → a AuCl4− (aq) + b H2O(l) + d NO(g)
Após balancear a equação acima com os menores números possíveis, correspondentes, a soma dos coeficientes estequiométricos será:
De acordo com os dados fornecidos sobre o Paraquat, determine a sua fórmula mínima e a sua fórmula molecular, respectivamente.
A chuva ácida intensifica a degradação de monumentos históricos. A maioria desses monumentos é feita de mármore, que é o carbonato de cálcio na forma cristalina, CaCO3(s), e de pedra-sabão, que tem o carbonato de sódio, Na2CO3(s), como um de seus constituintes. Esses sais, CaCO3(s) e Na2CO3(s), são pouco solúveis em água, mas, em meio ácido, o íon carbonato é convertido em H2CO3, o qual, por sua vez, decompõe-se em água e CO2, conforme a equação de equilíbrio apresentada abaixo.

A partir dessas informações, e considerando que uma solução saturada de CaCO3 apresente comportamento ideal e que a constante de solubilidade do CaCO3 seja igual a 8,1 × 10-9 , julgue o item que se segue.
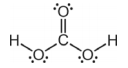
A estrutura reproduzida abaixo corresponde à estrutura de Lewis do H2CO3.

“O ácido Sulfúrico é tido como um indicador da economia de um país, pois é o produto químico mais utilizado
pela indústria. Sua aplicação tem larga escala, desde em fertilizantes e baterias de automóveis, até
no refino do petróleo. É extremamente solúvel em água, porém, isto deve ser feito com muita cautela,
pois seus vapores são liberados agressivamente”.
Disponível em: <http://www.brasilescola.com/> .
Uma das maneiras de produzi-lo é através das reações com oxigênio, o qual ocupa uma fração de 21%, aproximadamente, no ar atmosférico. A partir das informações fornecidas e utilizando as reações não balanceadas apresentadas a seguir, referentes às etapas de produção de ácido sulfúrico, assinale a alternativa CORRETA.
Dados: (Ma (g/mol): H = 1, O = 16, S= 32). Volume molar na CNTP: 22,71 L/mol, Avogadro = 6X1023
I) S8(s) + O2(g) → SO2(g)
II) SO2(g)+ O2(g) → SO3(g)
III) SO3(g) + H2O (l) → H2SO4 (aq)
O ácido permangânico é um composto instável, de cor branca, extremamente corrosivo, o qual oxida em soluções aquosas. Já o hidróxido de ferro III é uma base insolúvel em água que, em conjunto com outras substâncias, pode servir, por exemplo, em medicina para ajudar a tratar anemias.
Disponível em: <http://www.quimica.seed.pr.gov.br> .
No que diz respeito aos ácidos e bases, assinale a alternativa CORRETA.
Dadas massas atômicas em (g/mol): H = 1, O = 16, Mn = 55, Fe = 56
