Questões de Vestibular
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 380 questões
O sulfato de potássio e o permanganato de potássio são duas importantes substâncias. O sulfato de potássio é utilizado na agricultura como um dos constituintes dos fertilizantes, pois ajuda na adubação das culturas que estão com carência de potássio, ao passo que o permanganato de potássio é utilizado no tratamento da catapora, pois ajuda a secar os ferimentos causados pela doença. A reação a seguir mostra uma maneira de produzir o sulfato de potássio a partir do permanganato de potássio. Considerando as informações apresentadas e a análise da reação não balanceada, assinale a alternativa CORRETA.
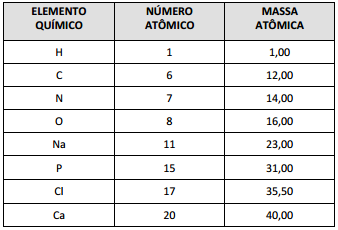
Dados: massas atômicas em (g/mol): H= 1, O= 16, S = 32, K = 39, Mn = 55
KMnO4(aq) + H2SO4(aq) + H2O2(aq) → K2SO4(aq) + H2O(l) + MnSO4(aq) + O2(g)
DADOS QUE PODEM SER USADOS NESTA PROVA
O fermento é responsável pelo aumento do volume de um bolo, que acontece assim: a temperatura alta faz com que o fermento libere gás carbônico; esse gás se expande e faz o bolo crescer. Quando adicionado na massa, o fermento sofre uma transformação química a partir da reação entre bicarbonato de sódio e fosfato dihidrogenado de cálcio:
NaHCO3 + Ca(H2 PO4)2 —–>
Assinale a opção que apresenta corretamente os
produtos ajustados dessa reação química.
INSTRUÇÃO: Para responder à questão, analise o texto a seguir.
Construir casas e edifícios exige uma escolha criteriosa
de materiais de construção, levando em conta aspectos
de segurança, durabilidade e custo adequado. Por
exemplo, certos elementos, como vigas, colunas e paredes,
precisam ter boas propriedades mecânicas; as
partes expostas devem resistir à erosão causada pela
água e pelo ar; o risco de incêndio deve ser minimizado
pelo uso de materiais não inflamáveis.
Consideradas essas exigências, duas substâncias que
poderiam estar presentes na composição desses materiais
são:
A criolita é um minério cujo principal componente é o fluoreto de alumínio e sódio. Sua principal aplicação é na produção do alumínio, onde é adicionada à alumina (óxido de alumínio), obtendo-se uma mistura de o temperatura de fusão de 950°C, tornando economicamente viável a eletrólise da alumina e a obtenção do metal alumínio.
A relação entre a massa de sódio e de alumínio na
criolita é de 23/9 e, portanto, a fórmula mínima do
fluoreto de alumínio e sódio é
Os palitos de fósforo são dispositivos simples empregados para fazer fogo. A chama se produz por meio de reações que ocorrem com as substâncias da “cabeça” do palito. Quando o palito é esfregado na superfície áspera da lateral da caixa, as substâncias reagem formando Sb2 O5 , KCl e SO2 . Essa reação é muito exotérmica e rápida e promove a reação de combustão e a propagação da chama pela madeira do palito.
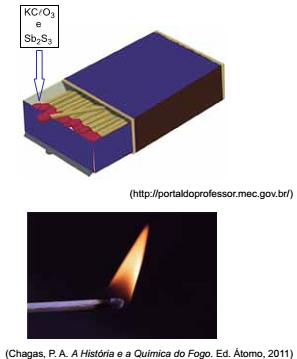
Equacionando-se e fazendo-se corretamente o balanceamento
da reação que ocorre pelo atrito da cabeça do palito de
fósforo com a lateral da caixa, a soma dos menores valores
inteiros dos coeficientes estequiométricos é
Um novo tipo de material especial, seleneto de bismuto, capaz de conduzir eletricidade em sua superfície, não em seu interior, quando em contato com um semicondutor, arseneto de gálio, resulta em um material que conduz eletricidade em várias direções e com níveis de energia diferentes. Esses compostos seguem a fórmula XyYx e suas ligações podem ser consideradas iônicas. Os íons negativos seguem a regra do octeto, enquanto que os íons positivos apresentam a mesma carga que o íon alumínio.
(Revista Pesquisa Fapesp, 234, agosto de 2015. Adaptado)
Os índices y e x nas fórmulas do material especial e do semicondutor são, respectivamente:
A luz branca é composta por ondas eletromagnéticas de todas as frequências do espectro visível. O espectro de radiação emitido por um elemento, quando submetido a um arco elétrico ou a altas temperaturas, é descontínuo e apresenta uma de suas linhas com maior intensidade, o que fornece “uma impressão digital” desse elemento. Quando essas linhas estão situadas na região da radiação visível, é possível identificar diferentes elementos químicos por meio dos chamados testes de chama. A tabela apresenta as cores características emitidas por alguns elementos no teste de chama:
Elemento Cor
sódio laranja
potássio violeta
cálcio vermelho-tijolo
cobre azul-esverdeada
PbCO3(s) + 2 HNO3(aq) ® Pb(NO3)2(aq) + H2O (ℓ) + CO2(g) (Equação 1)
Pb(NO3)2(aq) + H2SO4(aq) ® PbSO4(s) + 2 HNO3(aq) (Equação 2)
Supondo que uma amostra de 0,79 g do mineral tenha produzido 0,84 g de PbSO4, pode-se concluir que a porcentagem em massa de PbCO3 na amostra é, em valores arredondados, de
Para diferenciar os hidrocarbonetos etano e eteno em uma mistura gasosa, utiliza-se uma reação com bromo molecular: o etano não reage com esse composto, enquanto o eteno reage de acordo com a seguinte equação química:
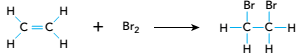
Considere um cilindro de capacidade igual a 10 L, contendo apenas esses hidrocarbonetos em uma mistura com massa igual a 200 g. Ao se adicionar bromo em excesso à mistura, todo o eteno reagiu, formando 940 g de 1,2-dibromoetano.
A concentração inicial de etano, em mol.L–1, no interior do cilindro, corresponde a:


Um dos álcoois mais comuns, o etanol, queima completamente segundo a reação
C2H6O (l) + 3O2 (g) → 2CO2 (g) + 3H2O (g)
Considerando que todos os produtos dessa reação são gasosos, o volume de gás total, em m3 , produzido quando é queimado 1,0 kg de etanol, nas CNTP, é de, aproximadamente,
Dados:
Massas molares (g.mol−1 )
H = 1,0
C = 12,0
O = 16,0
Volume molar, nas CNTP = 22,4 L.mol−1
O suco gástrico contém um ácido, produzido pelas células da parede do estômago, que desempenha papel fundamental para a eficiência do processo digestório no ser humano.
O ânion do ácido produzido no estômago corresponde ao elemento químico pertencente ao grupo 17 e ao terceiro período da tabela de classificação periódica.
Esse ácido é denominado:
A fórmula molecular que representa o composto 4-metil-3-heptanona é:

II) A etapa 2 de separação dos gases ocorre por liquefação seguida de destilação fracionada.
III) O processo Haber-Bosch consiste em uma reação de síntese total.
IV)Asoma dos coeficientes mínimos e inteiros da equação na etapa 4 é 19.
V) A etapa 4 é uma reação catalítica de oxirredução.
A sequência correta que corresponde, respectivamente, à questão é