Questões de Vestibular
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 380 questões
Uma amostra de 4,99 g desse sal hidratado foi aquecida até que toda a água nela contida evaporou, obtendo-se uma massa de 3,19 g de sulfato de cobre II. O número de mols de água por mol de sulfato de cobre II na composição do sal hidratado equivale a:
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
As2S3 +HNO3 + H2O → H3AsO4 + H2SO4 +NO,
marque a única afirmação verdadeira.
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
I. FeS2 + O2 → Fe2(SO4)3 + SO2
II. Fe2(SO4)3 + H2O → Fe(OH)3 + H2SO4
III. H2SO4 + KNO3 → KHSO4 + HNO3
A partir da leitura do texto e da interpretação das equações, assinale com V ou F, conforme sejam verdadeiras ou falsas, as assertivas abaixo.
( ) A equação I traduz uma reação de deslocamento.
( ) A soma dos coeficientes da equação II é 13.
( ) Na equação III, existe um sal ácido.
( ) Na pirita, o nox do ferro é +2.
( ) Para produzir 94,5 kg de ácido nítrico, são necessários 121,5 kg de salitre.
( ) A equação II traduz uma reação de óxido redução.
A sequência correta, de cima para baixo, é:
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
1. Colocou-se água em um copinho descartável de café, até aproximadamente um pouco mais da metade da sua capacidade.
2. Foi pesado o conjunto: copinho com a água e um comprimido efervescente, contendo bicarbonato de sódio, ainda em sua embalagem. Em seguida, foi anotada a massa do conjunto, que foi chamada de mi (massa inicial).
3. O comprimido foi retirado da embalagem e transferido para o copinho com água; em seguida, rapidamente o copinho foi coberto com a embalagem do comprimido, para evitar perda de material por espirramento.
4. No final da efervescência, pesou-se novamente o conjunto, incluindo a embalagem vazia, anotando-se a massa, chamada de mf (massa final).
Com relação a essa experiência, assinale a afirmação correta.
CS2(l) + 3O2(g) → CO2(g) + 2SO2(g)
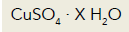
Uma amostra de 4,99 g desse sal hidratado foi aquecida até que toda a água nela contida evaporou, obtendo-se uma massa de 3,19 g de sulfato de cobre II. O número de mols de água por mol de sulfato de cobre II na composição do sal hidratado equivale a:
P4 + H2O → PH3 + H3PO4
A soma dos menores valores inteiros dos coeficientes estequiométricos dessa equação corretamente balanceada é igual a
Para representarem corretamente o modelo da molécula do C4H8O2, as bolas de plástico tinham tamanhos diferentes (pequenas, médias e grandes). Suas massas, em gramas, eram iguais aos valores das massas molares dos elementos C, H e O. Em escala ampliada para centímetros, seus raios tinham a mesma ordem de tamanho dos raios atômicos dos átomos que representavam.
Sobre essas bolas de plástico que representam as características de tamanho e massa dos átomos de C, H e O, os alunos concluíram:
I. as bolas que representam os átomos de H eram as pequenas, e as que representam os átomos de O eram as grandes;
II. a massa total das bolas grandes correspondia a seis vezes a massa total das bolas de tamanho pequeno;
III. a massa total das bolas pequenas correspondia a ¼ da massa total das bolas de tamanho médio.
Classificando cada uma das conclusões como verdadeira (V) ou falsa (F), tem-se, correta e respectivamente:
Uma estudante de Química realizou o seguinte experimento: pesou um tubo de ensaio vazio, colocou nele um pouco de NaHCO3 (s) e pesou novamente. Em seguida,adicionou ao tubo de ensaio excesso de solução aquosa de HCl, o que provocou a reação química representada por
NaHCO3(S) + HCl(aq) → NaCl(aq) + CO2(g) +H2O(l)
Após a reação ter-se completado, a estudante aqueceu o sistema cuidadosamente, até que restasse apenas um sólido seco no tubo de ensaio. Deixou o sistema resfriar até a temperatura ambiente e o pesou novamente. A estudante anotou os resultados desse experimento em seu caderno, juntamente com dados obtidos consultando um manual de Química:

A estudante desejava determinar a massa de
I. HCl que não reagiu;
II. NaCl que se formou;
III. CO2 que se formou.
Considerando as anotações feitas pela estudante, é possível
determinar a massa de
Em relação aos nitritos e nitratos, é correto afirmar que

CO(g) + H2(g) → H3 COH(g)
Nesta equação
N2 H4(g) + 2 H2 O2(l) → N2(g) + 4 H2O(g) ΔH = - 644,0 kJ
Com excesso de peróxido de hidrogênio e supondo 100% o rendimento da reação, é possível determinar a massa de hidrazina que, ao ser consumida, produzirá energia equivalente a 2.576 kJ. Esse valor, em gramas, é
Dados:
N - 14 u
H - 1 u
O - 16 u
Dados de massas molares em g mol-1 : C=12; N=14 e O=16.