Questões de Vestibular
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 380 questões
Distribuição esquemática de íons
de um sal dissolvido em água
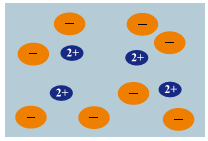
O composto que representa melhor a solução esquematizada na figura é:
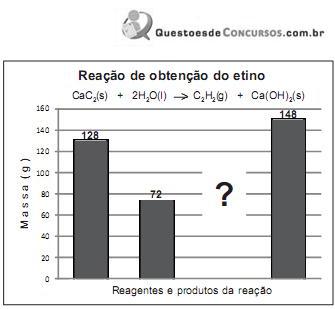
A massa, em gramas, de etino obtido nessa reação, que corresponde à coluna representada pelo ponto de interrogação, é

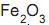 e impurezas. Ao se misturar 4,0 g de uma amostra deste minério com ácido clorídrico concentrado, obtêm- se 6,5 g de cloreto de ferro III. A porcentagem em massa de
e impurezas. Ao se misturar 4,0 g de uma amostra deste minério com ácido clorídrico concentrado, obtêm- se 6,5 g de cloreto de ferro III. A porcentagem em massa de 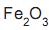 no minério é igual a
no minério é igual a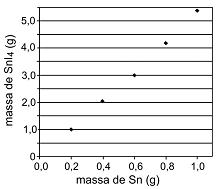
Com base nesses resultados experimentais, é possível afirmar que o valor da relação
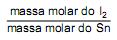
é, aproximadamente,
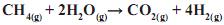
Em relação a este processo, é CORRETO afrmar que, ao reagir

Essa afirmação está baseada na lei de:

Assinale abaixo a fórmula molecular correta da glicerina.
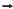 Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é
Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio éCa10(PO4)6OH2(s)+H+ (aq) ↔Ca2+ (aq)+HPO4 2– (aq)+ H2O(l)
A reação direta, que enfraquece o esmalte e produz a cárie, é conhecida como desmineralização, e a reação inversa como mineralização.
Sobre o sistema acima indicado, assinale a afirmação FALSA.
Assinale a alternativa que mostra corretamente a provável estrutura do óxido nitroso.
Questão Discursiva
Em um frasco de 1,0 L, foram colocados, a determinada temperatura, 0,880 g de N2O e 1,760 g de O2 gasosos, para reagir. Após se estabelecer o equilíbrio químico, foi formado 1,012 g de gás NO2. Considerando essas condições, calcule a concentração molar de equilíbrio do O2 e multiplique o resultado por 104 . Para marcação no Caderno de Respostas, despreze, caso exista, a parte fracionária do resultado obtido, após ter efetuado todos os cálculos solicitados.
R:385
Após se balancear a equação xNH3 + yO2 ? zN2 + wH2O — que representa a combustão da amônia — usando-se os menores valores inteiros positivos para seus coeficientes estequiométricos, verifica-se que o resultado da soma x + y + z + w é um múltiplo inteiro de 5.
Considerando-se o rendimento de 100% para a reação de combustão do nitrato de amônio, é correto afirmar que a quantidade de explosivo utilizada na referida demolição da arquibancada do estádio Mané Garrincha produziu mais de 9,0 × 105 kJ de energia.
Com relação a essas substâncias, assinale a afirmação correta.
I. K2S(aq.) + 2 HCℓO3(aq.) → 2 KCℓO3(aq.) + H2S(aq.)
II. Zn(OH) 2(s) → ZnO(s) + H2O(ℓ)
III. Cℓ2(g) + 2 HI(aq.) → I2(s) + 2 HCℓ(aq.)
A classificação da reação equacionada e o nome do composto em negrito são respectivamente:


