Questões de Vestibular
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 379 questões

O dihidrogenofosfato de sódio, NaH2PO4, é um conservante utilizado em alimentos.
Em relação a esse conservante, é correto afirmar:
O besouro-bombardeiro consegue afastar seus predadores, lançando sobre eles um jato quente e repelente de quinona, substância produzida em seu abdômen, através da reação química entre hidroquinina e peróxido de hidrogênio. O fenômeno pode ser representado pela equação:
C6 H6 O2(aq) + H2O2(aq) → C6 H4O2(aq) + 2H2 O ∆H = –204 kJ/mol
Hidroquinona Quinona
Muitos dos estudos mais antigos sobre as reações do ouro surgiram da prática da alquimia com objetivo de transformar metais nesse elemento químico. Os alquimistas descobriram que o ouro pode ser dissolvido em uma mistura de ácidos clorídrico e nítrico concentrados, na proporção de 3:1, conhecida como água régia, de acordo com a equação química simplificada não balanceada.
Considerando-se essas informações e a partir do balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
Considerando-se essas informações sobre os sais hidratados, é correto afirmar.
Massas molares em g/mol: Xe = 131; Pt = 195; F = 19
A letra do funk carioca acima diz respeito ao anabolizante injetável Deca-durabolim, produto da indústria farmacêutica comercializado em caixas de 25 mg e 50 mg do decanoato de nandrolona (C18H26O2 ), substância proibida para atletas profissionais, sob pena de dopping.
Sobre essa substância, assinale a alternativa INCORRETA.
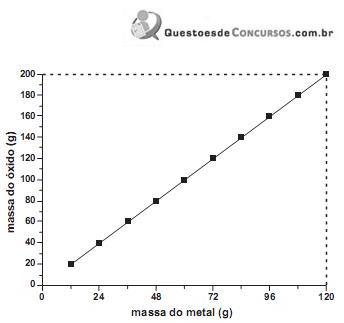
Durante um experimento, realizado em recipiente fechado, foi colocado para reagir 1,00 g do referido metal, obtendo-se 1,40 g do seu óxido. Considerando-se que todo o oxigênio presente no frasco foi consumido, pode-se determinar que a massa de oxigênio presente no sistema inicial é x . Em outro recipiente fechado, foram colocados 1,50 g do referido metal em contato com 1,20 g de oxigênio. Considerando que a reação ocorreu até o consumo total de pelo menos um dos reagentes, pode- se afirmar que amassa de óxido gerado é y . Sabendo que ometal emquestão forma apenas um cátion estável e considerando que em todas as reações o rendimento foi de 100 %, os valores de x e y são, respectivamente,
NaCl + MnO2 + H2SO4 → Na2SO4 + Cl2 + H2O
Sabendo que a mesma teve um rendimento de 80% e foi realizada a uma temperatura de 27 °C e a uma pressão de 1 atm e que utilizou 600 g de NaCl, o volume de Cl2 obtido, em litros, foi, aproximadamente,
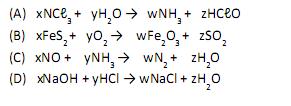
Fazendo-se o balanceamento destas reações, analise as proposições:
I. na reação descrita no item (A), a soma dos coeficientes estequiométricos (x, y, w e z) é 08;
II. na reação descrita no item (B), a soma dos coeficientes estequiométricos (x, y, w e z) é 25;
III. na reação descrita no item (C), a soma dos coeficientes estequiométricos (x, y, w e z) é 10;
IV. na reação descrita no item (D), a soma dos coeficientes estequiométricos (x, y, w e z) é 04.
Assinale a alternativa correta considerando as proposições acima.
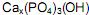 , sendo o valor de x igual a:
, sendo o valor de x igual a: 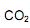 coletados no cubo é igual a:
coletados no cubo é igual a: 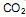 precisa ser retirado. Sabendo-se que o
precisa ser retirado. Sabendo-se que o 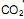 é um óxido ácido, esses trajes possuem um sistema de purificação do ar contendo basicamente hidróxido de lítio, substância que, em contato com o
é um óxido ácido, esses trajes possuem um sistema de purificação do ar contendo basicamente hidróxido de lítio, substância que, em contato com o 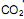 produz carbonato de lítio e água. Considerando que o traje espacial possui uma capacidade máxima de volume para expandir, além do corpo da pessoa, de 5,2 Litros, a temperatura e pressão constantes de 29ºC e 760 mmHg, respectivamente. Qual a massa de hidróxido de lítio necessário para retirar todo o
produz carbonato de lítio e água. Considerando que o traje espacial possui uma capacidade máxima de volume para expandir, além do corpo da pessoa, de 5,2 Litros, a temperatura e pressão constantes de 29ºC e 760 mmHg, respectivamente. Qual a massa de hidróxido de lítio necessário para retirar todo o 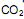 produzido quando o traje atingir seu volume máximo? (Dado: R= 0,082 atm L mol -1 K-1 )
produzido quando o traje atingir seu volume máximo? (Dado: R= 0,082 atm L mol -1 K-1 ) O chumbo é obtido da galena (PbS) através da sequência de reações não balanceadas, apresentadas a seguir.
x PbS(s) = y O2 (g) → z PbO(s) + w SO2(g)
PbS(s) + PbO(s) → Pb(s) + SO2(g)
A soma dos coeficientes estequiométricos representados por x, y, z e w resulta no seguinte valor:
De acordo com o texto, a seqüência de fórmulas moleculares dos ácidos destacados, considerando a ordem de leitura, é:

