Questões de Vestibular
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 380 questões
As reações de formação do dióxido de enxofre e do trióxido de enxofre e as respectivas variações de entalpia, ΔH, são:
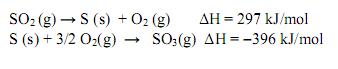
A formação de trióxido de enxofre a partir do dióxido de enxofre é dada pela reação:
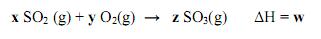
A alternativa que representa os valores indicados por x, y, z e w é:




Acerca dos temas tratados no texto, julgue os itens que se
seguem

Com base nessas informações e sabendo que, nas expressões
apresentadas, k é uma constante real a ser determinada, julgue os
itens subseqüentes


Com base nas informações do texto, julgue os itens de 19 a 33.


Com base nas informações do texto, julgue os itens de 19 a 33.
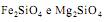 são óxidos básicos.
são óxidos básicos. Com base nas leis ponderais, pode-se afirmar que, segundo:
I a Lei da Conservação da Massa (Lavoisier), 1,0 g de Ferro ao ser oxidado pelo Oxigênio, produz 1,0 g de Óxido Férrico;
II a Lei da Conservação da Massa, ao se usar 16,0 g de Oxigênio molecular para reagir completamente com 40,0 g de Cálcio, são produzidas 56 g de Óxido de Cálcio;
III a Lei das Proporções Definidas, se 1,0 g de Ferro reage com 0,29 g de Oxigênio para formar o composto Óxido Ferroso, 2,0 g de Ferro reagirão com 0,87 g de Oxigênio, produzindo o mesmo composto;
IV a Lei das Proporções Múltiplas, dois mols de Ferro reagem com dois mols de Oxigênio para formar Óxido Ferroso; logo, dois mols de Ferro reagirão com três mols de Oxigênio para formar Óxido Férrico.
Assinale a opção correta.

Com base nessas informações, pode-se afirmar que:
Na reação representada pela equação: após o balanceamento, o coeficiente do agente oxidante
será
após o balanceamento, o coeficiente do agente oxidante
será



As duas reações que, então, ocorrem estão representadas nestas equações:
I) CO32- (aq) + H- (aq) → HCO3- (aq) II) HCO3- (aq) + H- (aq) → H2CO3 (aq)
Para se converterem os íons carbonato e bicarbonato dessa amostra em ácido carbônico,
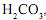 foram consumidos 20 mL da solução ácida. Pelo uso de ndicadores apropriados, é possível constatar-se que, na reação I, foram consumidos 5 mL dessa solução ácida e, na reação II, os 15 mL restantes.
foram consumidos 20 mL da solução ácida. Pelo uso de ndicadores apropriados, é possível constatar-se que, na reação I, foram consumidos 5 mL dessa solução ácida e, na reação II, os 15 mL restantes.Considerando-se essas informações, é CORRETO afirmar que, na amostra de água analisada, a proporção inicial entre a concentração de íons carbonato e a de íons bicarbonato era de
2 C6H6 (l) + 15 O2 (g) → 12 CO2 (g) + 6H2O (l) ΔH = -6,55 x 103 kJ
Suponha que uma amostra, contendo 2 mols de benzeno e 30 mols de oxigênio, é submetida à combustão completa em um sistema fechado.
Considerando-se essas informações, é CORRETO afirmar que, nesse caso, ao final da reação,
A massa desses reagentes e a de seus produtos estão apresentadas neste quadro:
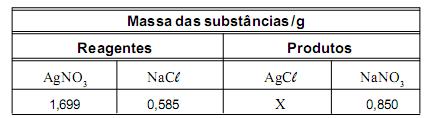
Considere que a reação foi completa e que não há reagentes em excesso.
Assim sendo, é CORRETO afirmar que X – ou seja, a massa de cloreto de prata produzida – é
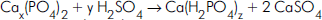
em que os valores de x, y e z são respectivamente
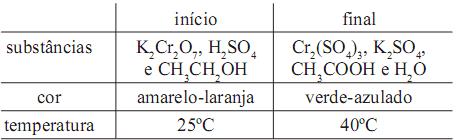
A soma dos índices estequiométricos da equação da reação devidamente balanceada e a classificação desta reação quanto ao calor envolvido são, respectivamente,

