Questões de Vestibular
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 380 questões
De acordo com o texto, a seqüência de fórmulas moleculares dos ácidos destacados, considerando a ordem de leitura, é:
2NaOH (aq) + Cl2(g) → NaClO(aq) + H2O(1)
Sobre o hipoclorito de sódio e a reação apresentada, é incorreto afirmar que:

A partir das informações do texto, julgue o item seguinte.

A partir das informações do texto, julgue o item seguinte.




A partir dessas informações, julgue o itens de 58 a 66, assinale
a opção correta no item 67 e faça o que se pede no item 68, que
é do tipo B.
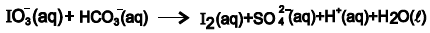
O iodato de sódio, NaIO3 , é utilizado como aditivo de sal de cozinha, NaCl, com objetivo de prevenir o bócio, uma doença provocada pela deficiência de iodo na alimentação. A equação química não balanceada representa a reação do íon iodato com o íon hidrogeno-sulfito, na determinação de iodo, I2 .
A partir do balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
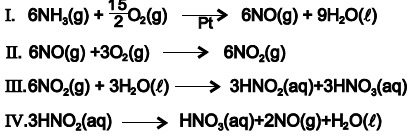
Com base nessas informações e de acordo com as equações químicas que representam o processo de fabricação do ácido nítrico, é correto afirmar:

Assim, considerando-se essas informações e os dados de decomposição de um determinado óxido de nitrogênio, NOx, relacionados na tabela, é correto afirmar:
Considerando a seguinte série de equações químicas propostas e fazendo o balanceamento destas equações,
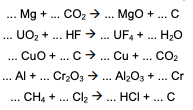
é INCORRETO afirmar que:
Al2(SO4)3 + Ca(OH)2 → Al(OH)3 + CaSO4
Os coeficientes estequiométricos desta reação são, respectivamente:
2 Se + Sn -> SnSe2
Em um experimento, deseja-se que haja reação completa, isto é, que os dois reagentes sejam totalmente consumidos. Sabendo-se que a massa molar do selênio (Se) é 2/3 da massa molar do estanho (Sn), a razão entre a massa de selênio e a massa de estanho (mSe : mSn), na reação, deve ser de
Um sal inorgânico, largamente utilizado em tais processos, pode ser obtido por meio da neutralização total entre as seguintes substâncias:
– hidróxido do metal de maior eletronegatividade do terceiro período da tabela periódica; – oxiácido contendo o elemento enxofre em seu estado de oxidação mais alto.
A fórmula desse sal está indicada em:


