Questões de Vestibular
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 380 questões
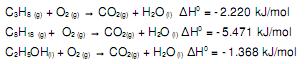
Com base nas fórmulas dos combustíveis e nas equações, considere as afirmativas a seguir:
I) O propano e o noctano são hidrocarbonetos saturados.
II) O noctano é aquele que libera maior quantidade de CO2(g) por mol de combustível
III) A soma dos coeficientes estequiométricos da reação de combustão do etanol é 8.
IV) 50 g de noctano libera maior quantidade de energia do que 100 g de propano.
Estão corretas apenas as afirmativas:

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.
Quantos elétrons são produzidos a partir da oxidação de 460 μg de etanol no interior de um bafômetro informado no texto acima.?
Dado: número de Avogrado: 6.1023 CH3CH2OH = 46 g/mol
2 NaOH(aq) + Cl2(g) → NaClO(aq) + NaCl(aq) + H2O(l)
Sobre o hipoclorito de sódio e a reação apresentada, é incorreto afirmar que:
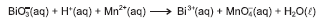
No balanceamento das equações de oxirredução, o fundamental é identificar o número de elétrons recebidos e cedidos, o número total de átomos de cada elemento químico no primeiro e segundo membros da equação química, além do total de carga elétrica em cada um de seus membros. Assim, com base nessas considerações, e a partir do balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
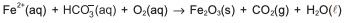
A presença de sais de ferro, a exemplo de bicarbonato de ferro (II), Fe(HCO3)2(aq), na água de abastecimento, deixa manchas de cor marrom quando a água goteja sobre a superfície de azulejos, pisos e vasos sanitários, em razão da formação de depósitos de óxido de ferro (III), Fe2O3(s).
Após análise dessas informações e do balanceamento da
equação química com coeficientes estequiométricos inteiros,
é correto afirmar:
Um professor realizou um experimento em um laboratório no qual ele realizou a queima de papel amassado e de esponja de aço, respectivamente, em balanças artesanais, conforme figura 1.

Um professor realizou um experimento em um laboratório no qual ele realizou a queima de papel amassado e de esponja de aço, respectivamente, em balanças artesanais, conforme figura 1.

Na indústria química, um dos gases mais utilizados é o cloro. Com relação à estrutura de sua molécula, assinale o que for correto.
Considerando que a estrutura molecular da fenilalanina está representada na figura
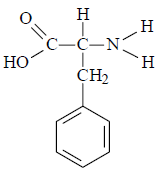
pode-se concluir que sua fórmula química é C9 H11 NO2.

A Lei, à qual Lavoisier faz referência no texto, constitui um fundamento essencial para se compreender e representar as reações químicas. Essa Lei é conhecida como
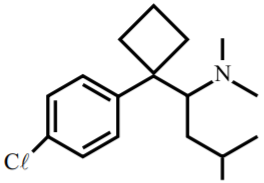
A fórmula estrutural do cloridrato de sibutramina está representada acima e, a respeito da mesma, considere as afirmações:
I. Existe um átomo de carbono terciário com hibridização sp2.
II. Sua fórmula molecular é C17H25NCℓ.
III. Possui 6 elétrons pi ressonantes.
IV. Apresenta os grupos funcionais haleto orgânico e amida.
Estão corretas, somente,
Considerando-se essas informações, é correto afirmar:
Disponível em < http://www.consciencia.net/2005/mês/10/taguchi-liebig.html> Acesso em: 1 nov. 2011.
Para suprir as necessidades das plantas por nitrogênio e potássio, podem ser utilizadas entre outras substâncias, o NaNO3 e o KCl.
Dadas as massas molares (g.mol-1): Na = 23, N = 14, O = 16, K = 39, Cl = 35,5
Estas substâncias apresentam em sua fórmula, respectivamente, teores de nitrogênio e potássio aproximadamente iguais a:
Esses indicadores foram selecionados devido à sua maior frequência na atmosfera e também devido aos efeitos adversos que causam ao meio ambiente. Para cada um deles, foram definidos padrões de qualidade do ar, ou seja, limites máximos de concentração que, quando ultrapassados, podem afetar a saúde, a segurança e o bem-estar da população, bem como ocasionar danos ao meio ambiente em geral.
Assim, por exemplo, o estudo de um desses indicadores demonstrou que não se devem deixar veículos com o motor em funcionamento em ambientes pouco ventilados, como garagens fechadas e túneis sem circulação adequada de ar, porque ele se combina com moléculas de hemoglobina, inutilizando-as irreversivelmente para o transporte de oxigênio.
Esse indicador é um gás inodoro representado pela fórmula molecular