Questões de Vestibular
Comentadas sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 151 questões
O hélio é um gás monoatômico, incolor e inodoro,
que apresenta o menor ponto de evaporação de todos os
elementos químicos, e só pode ser solidificado sob
pressão elevada. Embora seja o segundo elemento
químico em abundância no universo, encontram-se, na
atmosfera terrestre, apenas traços provenientes da
desintegração de alguns de seus elementos. Em alguns
depósitos naturais de gás, é encontrado em quantidade
suficiente para a sua exploração. Estima-se que uma
reserva encontrada na Tanzânia contenha mais de 15
bilhões de metros cúbicos desse gás.
Considerando a densidade He = 0.18 kg/m³ , indique o número de átomos do gás hélio existente na reserva.

Admita que foram consumidos 252 g de HNO3 para a completa dissolução das medalhas. Nesse caso, a massa, de NaHSO3 , em gramas, necessária para a recuperação de todo o ouro corresponde a:
Uma amostra de CaCl2 impura foi dissolvida e titulada com solução de AgNO3 :
CaCl2 + 2AgNO3 → Ca(NO3 )2 + 2AgCl
Determinou-se que 46.35 mL de uma solução de AgNO3 0.1034 M titulam uma amostra de CaCl2 de massa 0.2843 g.
O percentual de CaCl2
na amostra é

Em análises químicas, o carbono orgânico total é uma grandeza que expressa a concentração de carbono de origem orgânica em uma amostra.
Assim, com base nos dados da tabela, a concentração de carbono orgânico total na amostra de água examinada, em mg/L, é igual a:
A imagem mostra o primeiro avião do mundo movido a etanol (C2 H5 OH), o avião agrícola Ipanema, de fabricação brasileira.

Considere que a velocidade de cruzeiro dessa aeronave seja
220 km/h, que o consumo de combustível nessa velocidade
seja 100 L/h, que cada litro de combustível contenha 0,8 kg
de C2
H5
OH e que a combustão seja completa.
Em um percurso de 110 km, à velocidade de cruzeiro constante,
a massa de dióxido de carbono lançada ao ar devido à
combustão, em kg, é próxima de
Considere uma pulseira formada por 22 esferas de hematita (Fe2 O3 ), cada esfera com raio igual a 0,5 cm.

O fecho e o fio que unem as esferas dessa pulseira têm massas
e volumes desprezíveis e a densidade da hematita é cerca
de 5,0 g/cm3
. Sabendo que o volume de uma esfera é
calculado pela expressão 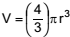 , a massa, em gramas,
dessa pulseira é próxima de
, a massa, em gramas,
dessa pulseira é próxima de
Uma forma de se obter oxigênio em laboratório é pela reação química entre solução aquosa de peróxido de hidrogênio (água oxigenada) e solução aquosa de permanganato de potássio em meio ácido, cuja equação, parcialmente balanceada, é:
xKMnO4(aq) + 3H2SO4(aq) + yH2O2(aq)→
→ K2SO4(aq) + 2MnSO4(aq) + zO2(g) + 8H2O(l)
Nessa equação, os valores dos coeficientes estequiométricos x, y e z são, respectivamente,
A bioluminescência é o fenômeno de emissão de luz visível por certos organismos vivos, resultante de uma reação química entre uma substância sintetizada pelo próprio organismo(luciferina) e oxigênio molecular, na presença de uma enzima (luciferase). Como resultado dessa reaçãobioquímica é gerado um produto em um estado eletronicamenteexcitado (oxiluciferina*). Este produto, por suavez, desativa-se por meio da emissão de luz visível, formandoo produto no estado normal ou fundamental (oxiluciferina).Ao final, a concentração de luciferase permanece constante.

O esquema ilustra o mecanismo geral da reação de bio-luminescência de vagalumes, no qual são formados dois produtos diferentes em estados eletronicamente excitados,responsáveis pela emissão de luz na cor verde ou na cor vermelha.

A luz branca é composta por ondas eletromagnéticas de todas as frequências do espectro visível. O espectro de radiação emitido por um elemento, quando submetido a um arco elétrico ou a altas temperaturas, é descontínuo e apresenta uma de suas linhas com maior intensidade, o que fornece “uma impressão digital” desse elemento. Quando essas linhas estão situadas na região da radiação visível, é possível identificar diferentes elementos químicos por meio dos chamados testes de chama. A tabela apresenta as cores características emitidas por alguns elementos no teste de chama:
Elemento Cor
sódio laranja
potássio violeta
cálcio vermelho-tijolo
cobre azul-esverdeada
Para diferenciar os hidrocarbonetos etano e eteno em uma mistura gasosa, utiliza-se uma reação com bromo molecular: o etano não reage com esse composto, enquanto o eteno reage de acordo com a seguinte equação química:
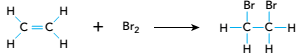
Considere um cilindro de capacidade igual a 10 L, contendo apenas esses hidrocarbonetos em uma mistura com massa igual a 200 g. Ao se adicionar bromo em excesso à mistura, todo o eteno reagiu, formando 940 g de 1,2-dibromoetano.
A concentração inicial de etano, em mol.L–1, no interior do cilindro, corresponde a:




Considere um reservatório hipotético com água de densidade 1 g/mL e volume igual ao do “volume morto” do Sistema Cantareira. Se a água desse reservatório encontra-se contaminada com 20 ppm de chumbo, a massa total deste metal na água do reservatório hipotético é
Soluções aquosas de ácido clorídrico, HCl (aq), e de ácido acético, H3CCOOH (aq), ambas de concentração 0,10 mol/L, apresentam valores de pH iguais a 1,0 e 2,9, respectivamente.
Em experimentos separados, volumes iguais de cada uma dessas soluções foram titulados com uma solução aquosa de hidróxido de sódio, NaOH (aq), de concentração adequada. Nessas titulações, a solução de NaOH foi adicionada lentamente ao recipiente contendo a solução ácida, até reação completa. Sejam V1 o volume da solução de NaOH para reação completa com a solução de HCl e V2 o volume da solução de NaOH para reação completa com a solução de H3CCOOH. A relação entre V1 e V2 é
Uma estudante de Química realizou o seguinte experimento: pesou um tubo de ensaio vazio, colocou nele um pouco de NaHCO3 (s) e pesou novamente. Em seguida,adicionou ao tubo de ensaio excesso de solução aquosa de HCl, o que provocou a reação química representada por
NaHCO3(S) + HCl(aq) → NaCl(aq) + CO2(g) +H2O(l)
Após a reação ter-se completado, a estudante aqueceu o sistema cuidadosamente, até que restasse apenas um sólido seco no tubo de ensaio. Deixou o sistema resfriar até a temperatura ambiente e o pesou novamente. A estudante anotou os resultados desse experimento em seu caderno, juntamente com dados obtidos consultando um manual de Química:

A estudante desejava determinar a massa de
I. HCl que não reagiu;
II. NaCl que se formou;
III. CO2 que se formou.
Considerando as anotações feitas pela estudante, é possível
determinar a massa de
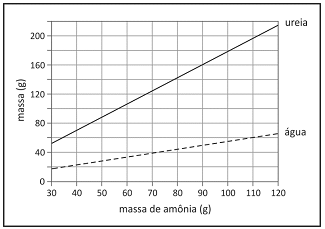
Amônia e gás carbônico podem reagir formando ureia e água. O gráfico ao lado mostra as massas de ureia e de água que são produzidas em função da massa de amônia, considerando as reações completas.
A partir dos dados do gráfico e dispondo-se de 270 g de amônia, a massa aproximada, em gramas, de gás carbônico minimamente necessária para reação completa com essa quantidade de amônia é