Questões de Vestibular
Sobre interações atômicas: geometria molecular, polaridade da ligação e da molécula, forças intermoleculares e número de oxidação. em química
Foram encontradas 329 questões
O tratamento biológico de efluentes e de resíduos dos esgotos, após a biodegradação de compostos orgânicos, inclui a nitrificação – conversão de íons amônio, NH4+ (aq), em nitrito, NO2– (aq), e, posteriormente, em nitrato, NO3– (aq) – por ação microbiana, conforme as etapas representadas, de maneira simplificada, pelas equações químicas I e II.
Considerando-se essas informações associadas às estruturas e propriedades dos íons envolvidos nas reações químicas representadas nas equações I e II, é correto afirmar:
Com relação ao método científico e a modelos e teorias desenvolvidos para explicar a estrutura e as propriedades das substâncias químicas, é correto afirmar:
De acordo com as estruturas de Lewis das moléculas descritas abaixo, identifique qual delas está desenhada de forma incorreta.
(Dados: Números atômicos: H = 1, C = 4, N = 5).
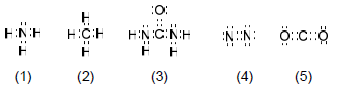
1) Cr2O3 2) K2Cr2O7 3) CrO3 4) K2Cr2O4
A partir dessas informações, qual(is) composto(s) de crômio acima listado(s) apresenta(m) maior potencial cancerígeno?
1) Sólidos iônicos geralmente são formados entre um elemento com grande número de orbitais vazios, na camada de valência, e um elemento com poucos orbitais vazios, na camada de valência. 2) Elementos muito eletronegativos tendem a formar compostos moleculares entre si. 3) Sólidos cristalinos não apresentam ordem definida no posicionamento dos átomos. 4) Líquidos que realizam ligações de hidrogênio intermolecular tendem a apresentar maiores pontos de ebulição.
Estão corretas
Com relação a essa descrição, três afirmações foram feitas:
1) A “ligação de hidrogênio” é um tipo de ligação entre o átomo de hidrogênio e átomos de oxigênio ou nitrogênio, e pode ocorrer de forma intermolecular (entre os átomos de diferentes moléculas).
2) As ligações de Van der Waals são ligações mais fortes que as ligações covalentes e ocorrem de forma intramolecular (entre os átomos de uma mesma molécula).
3) Numa ligação covalente ocorre o compartilhamento de elétrons entre dois átomos.
Está(ão) correta(s) a(s) afirmativa(s):
1) Os estados de oxidação do enxofre no SO2 e no SO3 são ambos iguais a +4. 2) O cloreto de sódio é considerado um sal neutro. 3) O número de oxidação do nitrogênio no KNO2 é igual a +3.
Está(ão) correta(s) a(s) afirmativa(s):
Dados: H (Z=1); Cl (Z=17); O (Z=8) e Na (Z=11)
I. Pertencem a mesma função inorgânica. II. O sal citado pode ser obtido da reação de HCl com NaOH. III.Só a água forma pontes de Hidrogênio. IV. Apresentam o mesmo tipo de ligação em sua estrutura.
São corretas apenas:
Texto a ser utilizado na questão.
Escorro o suor do meio dia
Assobiando a melodia
Eu tento saciar
Com o gole da cabaça
Passa a sede mas não passa
O jejum o jejum há.
O sol esquenta minha cabeça
Vixe maria não se esqueca
Também de esquentar
Com seus beijos minha vida
Eo sobejo da comida
Que sobrou do jantar.
João acabou-se a farinha
E o querosene da cozinha
No feijão "gurgui" já deu
Pai traz um vestido de chita
Que eu quero ficar bonita
Bonita que nem um mateu
Tenha paciência minha gente
Foi a seca e a enchente
E o culpado não sou eu.
(Música: Meio Dia, Luiz Fidelis)
Considerando as informações do texto, tem se as seguintes afirmativas:
I. O íons sódio e o potássio são metais de transição
II. O suor é uma mistura homogênea.
III. A falta de água no organismo induz a doenças porque as espécies vitais mudam suas concentrações e, consequentemente, o equilíbrio químico no interior do corpo.
IV. Os íons sódio, magnésio e cálcio liberados pelo suor, possuem cargas iguais a +1, +2 e +2, respectivamente.
Assinale a alternativa que reúne somente afirmativas corretas:
A água é um poderoso solvente, capaz de dissolver um grande número de substâncias e que possui diversas propriedades. Isso é possível devido à sua geometria molecular, polaridade e força intermolecular. Essas características atribuídas à água são:
Disponível em: <http://geoparkararipe.org.br/nascentes-da-chapada-do-araripe>. Acesso em 25/11/2018. (adaptado)
Chegando ao apartamento dos pais em Florianópolis, Carlos resolve fazer um café. Coloca água para ferver e aguarda. Algum tempo depois comenta: “- Essa água parece que demora mais para ferver aqui do que em Urubici!”.
Com base nas propriedades físicas das substâncias, é CORRETO afirmar que:
devido às forças intermoleculares, o ponto de ebulição da água é maior que o do H2S.
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Na reação representada pela equação I, o sódio se oxida e o nitrogênio se reduz.
Depois de terem percorrido cerca de 80 km, os dois amigos param para abastecer o carro. Após o abastecimento, Carlos tenta dar partida no veículo, porém nada acontece. Como o carro tem mais de 20 anos, ele não se surpreende e desce do mesmo para dar uma olhada. Ao abrir o capô, percebe que há um acúmulo de material azul esverdeado (zinabre) envolvendo os eletrodos da bateria.
Dado: o zinabre é uma mistura de CuCO3 e Cu(OH)2.
Sobre o assunto, é CORRETO afirmar que:
nas substâncias presentes no zinabre, o número de oxidação do cobre é igual a +2.
O seu traje habitual era, como o de todas as mulheres da sua condição e esfera, uma saia de lila preta, que se vestia sobre um vestido qualquer, um lenço branco muito teso e engomado ao pescoço, outro na cabeça (...). Nos dias dúplices, em vez de lenço à cabeça, o cabelo era penteado, e seguro por um enorme pente cravejado de crisólitas.
ALMEIDA, Manuel Antônio de. Memórias de um sargento de milícias. São Paulo:
Ática, 2003. p. 30.
A crisólita é um silicato de ferro e magnésio que tem fórmula geral (Mg, Fe)2SiO4, cujas colorações variam do amarelo ao verde. Possui teor de ferro de 10 a 30%, sendo utilizada na fabricação de refratários e em joalheria.
Dados os valores de energia de ionização (EI) em kJ mol-1 para:
magnésio: EI1 = 738; EI2 = 1450
silício: EI1 = 786; EI2 = 1580
De acordo com as informações acima, assinale a proposição CORRETA.
Na estrutura da crisólita, os átomos de ferro apresentam estado de oxidação +3.
Em uma indústria do Estado de São Paulo que produz ácido sulfúrico 98% a partir da queima de enxofre elementar, com capacidade de produção inicial de 600 toneladas por dia, ocorreu uma emissão de gás dióxido de enxofre (SO2). Essa emissão de gás ultrapassou as fronteiras da fábrica de ácido sulfúrico e atingiu a população do entorno. Várias pessoas apresentaram agravos à saúde relacionados ao caso, como irritação das vias aéreas, desmaios, vômitos e enjoos, demandando atendimento hospitalar de emergência em hospitais da região. Também foram acionados o Serviço de Atendimento Médico de Urgência (SAMU) e o Corpo de Bombeiros.
JÚNIOR, L.M.; LORENZI, R.L. Revista brasileira de saúde ocupacional. São Paulo: 32(116): 31-37, 2007. (Adaptado)
Sobre o assunto, é CORRETO afirmar que:
o SO2 deve ser oxidado a SO3 durante o processo de produção do ácido sulfúrico.
Em uma indústria do Estado de São Paulo que produz ácido sulfúrico 98% a partir da queima de enxofre elementar, com capacidade de produção inicial de 600 toneladas por dia, ocorreu uma emissão de gás dióxido de enxofre (SO2). Essa emissão de gás ultrapassou as fronteiras da fábrica de ácido sulfúrico e atingiu a população do entorno. Várias pessoas apresentaram agravos à saúde relacionados ao caso, como irritação das vias aéreas, desmaios, vômitos e enjoos, demandando atendimento hospitalar de emergência em hospitais da região. Também foram acionados o Serviço de Atendimento Médico de Urgência (SAMU) e o Corpo de Bombeiros.
JÚNIOR, L.M.; LORENZI, R.L. Revista brasileira de saúde ocupacional. São Paulo: 32(116): 31-37, 2007. (Adaptado)
Sobre o assunto, é CORRETO afirmar que:
a molécula de SO2 é apolar devido à sua geometria.
Considerando uma espécie química monoatômica que tem 78 prótons, 117 nêutrons e 74 elétrons, analise as seguintes afirmações:
I.É um metal de transição do bloco d.
II.Essa espécie química é um cátion, com estado de oxidação +4.
III.O número de massa do elemento é 117.IV.Essa espécie química é um ânion, com estado de oxidação –4.
Está correto somente o que se afirma em