Questões de Vestibular Comentadas sobre química
Foram encontradas 1.427 questões
Leia o texto e examine a tabela para responder à questão.
O ano de 2015 foi eleito como o Ano Internacional da Luz, devido à importância da luz para o Universo e para a humanidade. A iluminação artificial, que garantiu a iluminação noturna, impactou diretamente a qualidade de vida do homem e o desenvolvimento da civilização. A geração de luz em uma lâmpada incandescente se deve ao aquecimento de seu filamento de tungstênio provocado pela passagem de corrente elétrica, envolvendo temperaturas ao redor de 3000 °C.
Algumas informações e propriedades do isótopo estável do tungstênio estão apresentadas na tabela.
Símbolo W
Número atômico 74
Número de massa 184
Ponto de fusão 3422 °C
Eletronegatividade (Pauling) 2,36
Densidade 19,3 g· cm–3
Leia o texto e examine a tabela para responder à questão.
O ano de 2015 foi eleito como o Ano Internacional da Luz, devido à importância da luz para o Universo e para a humanidade. A iluminação artificial, que garantiu a iluminação noturna, impactou diretamente a qualidade de vida do homem e o desenvolvimento da civilização. A geração de luz em uma lâmpada incandescente se deve ao aquecimento de seu filamento de tungstênio provocado pela passagem de corrente elétrica, envolvendo temperaturas ao redor de 3000 °C.
Algumas informações e propriedades do isótopo estável do tungstênio estão apresentadas na tabela.
Símbolo W
Número atômico 74
Número de massa 184
Ponto de fusão 3422 °C
Eletronegatividade (Pauling) 2,36
Densidade 19,3 g· cm–3
A titulação de 50 mL de uma solução aquosa de ácido clorídrico, com uma solução aquosa de hidróxido de sódio de concentração molar igual a 0,1 mol/L, utilizando fenolftaleína como indicador, está representada no gráfico a seguir.
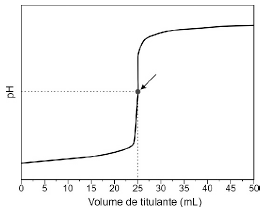
Considerando as informações do enunciado e do gráfico, assinale a alternativa correta.
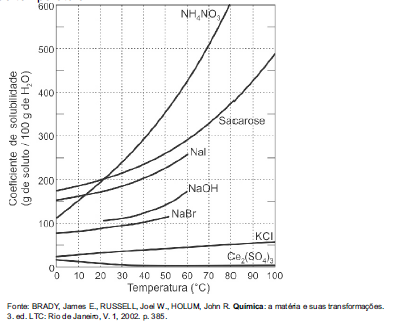
Considerando as informações apresentadas pelo gráfico acima, assinale a alternativa correta.
Para diferenciar os hidrocarbonetos etano e eteno em uma mistura gasosa, utiliza-se uma reação com bromo molecular: o etano não reage com esse composto, enquanto o eteno reage de acordo com a seguinte equação química:
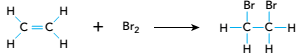
Considere um cilindro de capacidade igual a 10 L, contendo apenas esses hidrocarbonetos em uma mistura com massa igual a 200 g. Ao se adicionar bromo em excesso à mistura, todo o eteno reagiu, formando 940 g de 1,2-dibromoetano.
A concentração inicial de etano, em mol.L–1, no interior do cilindro, corresponde a:
Para descrever o comportamento dos gases ideais em função do volume V, da pressão P e da temperatura T, podem ser utilizadas as seguintes equações:
Equação de Clapeyron Equação de Boltzmann
P × V = n × R × T P × V = N × k × T
n – número de mols N – número de moléculas
R – constante dos gases k – constante de Boltzmann
De acordo com essas equações, a razão R/k é aproximadamente igual a:
A ionização do ácido cianídrico é representada pela equação química abaixo:
HCN (aq)  H+ (aq) + CN–
(aq)
H+ (aq) + CN–
(aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo
grau de ionização α
constante de equilíbrio Ka
potencial hidrogeniônico pH
concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte
símbolo:
O íon oxalacetato participa não só do ciclo de Krebs como também da produção do íon aspartato, segundo a equação abaixo:
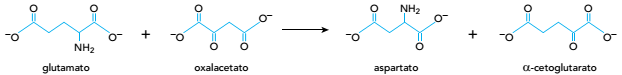
Com base nessa reação, pode-se afirmar que o aspartato é o ânion correspondente ao ácido
dicarboxílico denominado:


Considere as seguintes afirmações:
I. A aparência macroscópica do fleróvio é desconhecida, mas, provavelmente, será a de um sólido metálico.
II. Na formação do fleróvio-288, por processo análogo ao da síntese do fleróvio-289, são liberados 3 prótons.
III. No grupo da tabela periódica ao qual pertence o fleróvio, há elementos que formam óxidos covalentes.
É correto o que se afirma apenas em

 . Assim, no esquema
. Assim, no esquema








Note e adote: Volume molar nas condições de produção de biogás: 24 L/mol; energia liberada na combustão completa da gasolina: 4,5 x 104 kJ/L.
Três provetas com capacidade para 100 mL foram preenchidas cada uma com um mol de uma substância líquida nas condições ambientes. O resultado foi o seguinte:
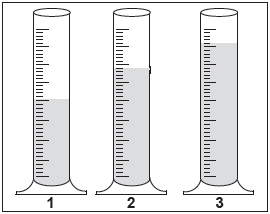 Com base nas informações acima, é possível que as substâncias nas provetas 1, 2 e 3 sejam, respectivamente,
Com base nas informações acima, é possível que as substâncias nas provetas 1, 2 e 3 sejam, respectivamente, 2 NaHCO3 (s) → Na2CO3 (s) + H 2O (g) + CO2 (g)
Considere o preparo de dois bolos com as mesmas quantidades de ingredientes e sob as mesmas condições, diferindo apenas na temperatura do forno: um foi cozido a 160 oC e o outro a 220 oC. Em ambos, todo o fermento foi consumido.
O gráfico que relaciona a massa de CO2 formada em função do tempo de cozimento, em cada uma dessas temperaturas de preparo, está apresentado em: