Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
1) segundo a nomenclatura IUPAC, o nome do ácido caprílico é ácido heptanóico. 2) apresenta uma ligação π. 3) é um ácido carboxílico saturado.
Está(ão) correta(s) a(s) afirmativa(s):
2 CO + 2 NO
 2 CO2 + N2
2 CO + O2
2 CO2 + N2
2 CO + O2  2 CO2
2 NO2
2 CO2
2 NO2  2 O2 + N2
2 O2 + N2Com relação às equações das reações descritas, analise as afirmações seguintes:
1) Todas as equações envolvem catálise heterogênea.
2) Os catalisadores são consumidos nas reações.
3) Os catalisadores diminuem a energia de ativação das reações, aumentando assim a velocidade.
Está(ão) correta(s) a(s) afirmativa(s):
8 Cl2(g) + 8 H2S(aq) → S8(s) + 16 HCl(aq)
Analisando a reação redox acima, três afirmações foram feitas:
1) O H2S é o agente oxidante.
2) O NOX (número de oxidação) do cloro varia de zero para -1; portanto, o cloro sofre redução.
3) Cada mol de Cl2 gasoso recebe 2 mol de elétrons.
Está(ão) correta(s) a(s) afirmativa(s):
NaHCO3(aq) + HCl(aq) → NaCl(aq) + H2CO3(aq) H2CO3(aq)
 H2O(l) + CO2(g)
H2O(l) + CO2(g)
Com relação às reações acima, três afirmações foram feitas:
1) O NaHCO3 é uma base que reage com HCl para gerar um novo ácido, o ácido carbônico.
2) O aumento da quantidade de H2CO3 no estômago desloca o equilíbrio para a formação de CO2, que explica o alívio e liberação de gás do estômago.
3) Quando tomamos NaHCO3 o pH do estômago aumenta.
Está(ão) correta(s) a(s) afirmativa(s):
CO(g) + 2 H2(g)
 CH3OH(g)
CH3OH(g)
Com relação a esse equilíbrio, três afirmações foram feitas:
1) A formação de metanol é favorecida pela remoção de CO.
2) O aumento da pressão não influencia o equilíbrio.
3) A adição de gás hidrogênio favorece a formação de metanol.
Está(ão) correta(s) a(s) afirmativa(s):
C6H12O6(s) + 6 O2(g)
 6 CO2(g) + 6 H2O(l)
6 CO2(g) + 6 H2O(l)
Sabendo os valores de entalpia (∆H = −2.805 kJ.mol−1) e entropia (∆S = 259 J.mol−1.K−1), à temperatura ambiente (25°C = 298 K), determine a energia livre de Gibbs (∆G) para esta reação e indique se a reação é espontânea ou não
C6H12O6(s) → 2 C2H5OH(l) + 2 CO2(g) ∆H°= −74,0 kJ.mol−1
Calcule a quantidade de glicose, em gramas, a ser fermentada para produzir 300 kJ de calor.
Dados: Massas molares em g.mol−1: H = 1; C = 12; O = 16.
x NH3(g) + y CuO(s) → t N2(g) + w Cu(s) + z H2O(g)
A soma dos coeficientes estequiométricos, x, y, t, w e z que tornam a equação balanceada é:
Ca3(PO4)2(s) + 3 H2SO4(aq) → 3 CaSO4(s) + 2 H3PO4(aq)
A mistura resultante de CaSO4 e H3PO4 é seca, pulverizada e espalhada pelos campos para plantações, onde o fosfato é dissolvido pelas águas das chuvas. Calcule a quantidade de ácido fosfórico produzida a partir de 1,00 kg de ácido sulfúrico.
Dados: Massas molares em g . mol−1: H = 1; O = 16; P = 31; S = 32.
Dados:
Massas molares em g . mol−1: Li = 7; C = 12; O = 16.
Com relação a essa descrição, três afirmações foram feitas:
1) A “ligação de hidrogênio” é um tipo de ligação entre o átomo de hidrogênio e átomos de oxigênio ou nitrogênio, e pode ocorrer de forma intermolecular (entre os átomos de diferentes moléculas).
2) As ligações de Van der Waals são ligações mais fortes que as ligações covalentes e ocorrem de forma intramolecular (entre os átomos de uma mesma molécula).
3) Numa ligação covalente ocorre o compartilhamento de elétrons entre dois átomos.
Está(ão) correta(s) a(s) afirmativa(s):
Com relação a essa descrição, três afirmações foram feitas:
1)
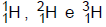 são isótopos do hidrogênio. 2)
são isótopos do hidrogênio. 2) 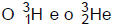 são elementos isóbaros. 3)
são elementos isóbaros. 3) 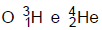 são elementos isótonos.
são elementos isótonos.
Está(ão) correta(s) a(s) afirmativa(s):
Com relação a essas descrições, três afirmações foram feitas:
1) Nos átomos ou moléculas, os elétrons podem absorver ou emitir energia, passando de um orbital para outro.
2) A teoria quântica foi fundamental para o desenvolvimento do modelo atômico atual.
3) O modelo atômico de Bohr é o modelo atômico mais atual.
Está(ão) correta(s) a(s) afirmativa(s):
1) O grafite e o diamante são formas alotrópicas do carbono.
2) O oxigênio molecular (O2) e o ozônio (O3) são formas alotrópicas do oxigênio.
3) A água e a água oxigenada são formas alotrópicas do íon hidróxido.
Está(ão) correta(s) a(s) afirmativa(s):
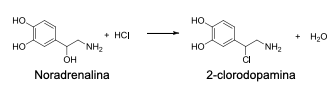
A reação acima pode ser classificada como:

Com base na estrutura do antranilato de metila, as funções orgânicas presentes na estrutura são:
:
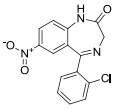
A partir da estrutura do clonazepam, foram realizadas três afirmações:
1) todos os carbonos da molécula possuem hibridização sp2. 2) a estrutura possui apenas um carbono primário. 3) a molécula possui fórmula elementar C15H10ClN3O3.
Está(ão) correta(s) a(s) afirmativa(s):