Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
O Transtorno de Déficit de Atenção e Hiperatividade (TDAH) é uma doença crônica, comum no mundo inteiro. Entre seus sintomas, é comum observar inquietação, irritabilidade, dificuldade de concentração, ansiedade e depressão. O tratamento consiste em psicoterapia e medicamentos. O Adderall, cujo princípio ativo é composto por dois isômeros, cujas estruturas (1 e 2) estão representadas abaixo.

Com base nas estruturas (1) e (2), assinale a
alternativa correta:
I2(s) + 2 e- → 2 I- (aq) E0 = +0,54 V
Li+ (aq) + e- → Li(s) E0 = -3,05 V
Com base nas reações de redução acima, foram realizadas as seguintes afirmações:
1) a ddp da bateria do marcapasso é de -3,59 V. 2) o Li(s) é considerado um forte agente redutor. 3) o I2 apresenta potencial de redução mais positivo que o Li+ , por isso, numa célula galvânica deve sofrer oxidação.
Está(ão) correta(s):
v H2S + w Br2 + x H2O → y H2SO4 + z HBr
A soma dos coeficientes estequiométricos (v, w, x, y e z) após o balanceamento da equação é igual a:
N2O(g) ⇄ N2(g) + ½O2(g) ∆Ho = – 68 kJ
Com relação à reação citada acima, três afirmações foram feitas:
1) O aumento da temperatura desloca o equilíbrio no sentido dos reagentes. 2) A reação acima é endotérmica. 3) Diminuindo-se a concentração de N2O, o equilíbrio é deslocado no sentido dos reagentes.
Está(ão) corretas:
Dado: massa molecular do metano = 16 g.mol-1.
1) Os estados de oxidação do enxofre no SO2 e no SO3 são ambos iguais a +4. 2) O cloreto de sódio é considerado um sal neutro. 3) O número de oxidação do nitrogênio no KNO2 é igual a +3.
Está(ão) correta(s) a(s) afirmativa(s):
w Ca3(PO4)2(aq) + x H2SO4(aq) → y H3PO4(aq) + z Ca(SO4)(aq)
Se utilizarmos 50 g de Ca3(PO4)2 e ácido sulfúrico em excesso, quantos gramas de ácido fosfórico podem ser obtidos através dessa reação?
Dados: massas moleculares em g.mol-1 : Ca3(PO4)2 = 310; H3PO4 = 98.
Dados: massa atômica do ferro = 56 g.mol-1.
Dados: massa molecular da glicose = 180 g.mol-1 e constante ebulioscópica (Ke) da água = 0,52°C.molal-1
Dados: massas molares em g.mol−1 : C = 12; H = 1;
Dado: número atômico do K = 19.
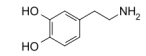
podemos afirmar que a dopamina:
1) apresenta fórmula elementar C8H9O2N2. 2) é um composto aromático. 3) apresenta grupos funcionais fenol e amina.
Está(ão) correta(s) a(s) afirmativa(s):
a KMnO4 + b Na2SO3 + c H2O → d MnO2 + e Na2SO4 + f KOH
A soma dos coeficientes estequiométricos a, b, c, d, e e f, que tornam a equação corretamente balanceada, deve ser: