Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
DADOS QUE PODEM SER USADOS NESTA PROVA

I.
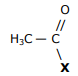 etanamida II. H3C — X nitrometano III. H3C — X — C2H5 metoxietano IV. H3C —
etanamida II. H3C — X nitrometano III. H3C — X — C2H5 metoxietano IV. H3C — 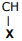 — CH3
|
X
propan-2-ol
— CH3
|
X
propan-2-ol Em relação às possíveis substituições de X nos itens acima, é correto dizer que X deve ser substituído por
DADOS QUE PODEM SER USADOS NESTA PROVA

Ag+(aq) + e– → Ag(s) Eo = + 0,80 volts Zn2+(aq) + 2e– → Zn(s) Eo = – 0,76 volts 2H+(aq) + 2e– → H2(g) Eo = 0,00 volts Pb2+(aq) + 2e– → Pb(s) Eo = – 0,13 volts Aℓ3+(aq) + 3e– → Aℓ (s) Eo = – 1,66 volts
Considerando as semirreações e seus potenciais padrões de redução, acima apresentados, é correto afirmar que Lindalva deve escolher o vasilhame de
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

Atente para as informações contidas na seguinte tabela:
Substância Calor de combustão (kcal/mol)
Carbono 1.646,92
Metano 3.720,20
Butano 12.038,40
Octano 22.822,80
De acordo com as informações da tabela acima, o
combustível capaz de produzir a maior quantidade de
calor por quilograma queimado é o
DADOS QUE PODEM SER USADOS NESTA PROVA

A reação abaixo representa a decomposição deum carbonato onde X é um metal.
XCO3(s) → XO(s) + CO2(g)
Quando utilizamos 1,70 g de XCO3, são produzidos0,88 g de XO. Com base nesta informação e usando cálculos aproximados, é correto dizer que o metal é
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

I. O subnível “s” contém o número máximo de elétrons. II. O subnível “p” contém o triplo do número de elétrons do subnível “s”. III. O subnível “d” contém o número x + 4 de elétrons, onde x é o número de elétrons que contém o subnível “p”. IV. O subnível “f” contém menos 3 elétrons do número de elétrons que contém o subnível “d”.
De acordo com a distribuição acima apresentada, é correto afirmar que o número total de elétrons deste nível energético é
DADOS QUE PODEM SER USADOS NESTA PROVA

I. 2-metil-pentano. II. Propano. III. Butano. IV. Cloroetano.
Sobre esses compostos, assinale a alternativa correta.
H3CCOH + 2Ag+ + 2NH3 + H2O → H3CCOOH + 2Ag(s) + 2NH+4
Assinale a alternativa que apresenta, corretamente, o agente redutor nessa reação.
Com base nos conhecimentos sobre funções orgânicas, relacione a coluna da esquerda com a da direita.
(I)
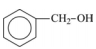 (A) Enol.
(A) Enol. (II) 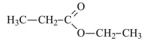 (B) Álcool.
(B) Álcool.
(III) 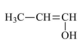 (C) Aldeído.
(C) Aldeído.
(IV) 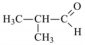 (D) Éter.
(D) Éter.
(V) 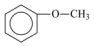 (E) Éster.
(E) Éster.
Assinale a alternativa que contém a associação correta.
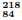 Po, as etapas sucessivas a seguir são observadas.
Po, as etapas sucessivas a seguir são observadas.
I.
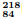 Po → α + W II. W → β + R
Po → α + W II. W → β + R
Com base nessas informações e nos conhecimentos sobre radioatividade, assinale a alternativa que indica, corretamente, o número de nêutrons que o núcleo do elemento R apresenta.
H2(g) + Cℓ2(g) ↔ 2HCℓ(g)
Supondo que em um recipiente fechado de 2,00 L de capacidade encontram-se 8,00 g de H2, 71,00 g de Cℓ2 e 146,00 g de HCℓ, assinale a alternativa que apresenta, corretamente, o valor da constante de equilíbrio em termos de concentração (Kc).
Dados: H = 1; Cℓ = 35,5
Com base nessa reação e expressão para a velocidade e nos conhecimentos sobre cinética, considere as afirmativas a seguir.
I. A adição do reagente B ao sistema resulta no aumento da velocidade da reação. II. A velocidade de desaparecimento de A é a metade da velocidade de aparecimento de C. III. A velocidade de desaparecimento de B é três vezes maior que a velocidade de aparecimento de C. IV. Os reagentes A e B são consumidos com a mesma velocidade.
Assinale a alternativa correta.
Substância Entalpia de formação (kcal/mol) CO2 −95,0 CO −25,0
Com base nessas informações e nos conhecimentos sobre termoquímica, assinale a alternativa que apresenta, corretamente, a entalpia da reação C(s) + CO2(g) → 2CO(g).
Com base no texto e nos conhecimentos sobre reações de oxirredução, considere as afirmativas a seguir.
I. O número de oxidação de qualquer elemento, ao formar uma substância simples, é zero. II. Agente redutor é a substância ou elemento que, após a reação, apresenta um número de oxidação maior. III. Agente oxidante é a substância que contém o elemento que sofre oxidação. IV. A soma algébrica dos números de oxidação de todos os átomos em um íon é zero.
Assinale a alternativa correta.
Com base nessas informações, assinale a alternativa que apresenta, corretamente, a concentração da solução de carbonato de sódio.
H2 HF NaF CO2
Com base nos conhecimentos sobre ligações químicas e suas propriedades, considere as afirmativas a seguir.
I. A molécula de NaF apresenta ligação iônica. II. A molécula do CO2 apresenta ligação covalente apolar. III. As moléculas HF e NaF apresentam o mesmo tipo de ligação em sua estrutura. IV. A ligação covalente no H2 é polar.
Assinale a alternativa correta.
Supondo que um paciente ingeriu um comprimido contendo 0,78 g de metformina (C4H11N5), assinale a alternativa que apresenta, correta e aproximadamente, a quantidade de moléculas desse fármaco ingerida.
Dados: C = 12; H = 1; N = 14; número de Avogadro = 6,0×1023