Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Leia o texto para responder à questão.
“Houston, we have a problem”. Ao enviar essa mensagem, em 13 de abril de 1970, o comandante da missão espacial Apollo 13 sabia que sua vida e as dos seus dois companheiros estavam por um fio. Um dos tanques de oxigênio (O2 ) tinha acabado de explodir. Apesar do perigo iminente dos astronautas ficarem sem O2 para respirar, a principal preocupação da NASA era evitar que a atmosfera da espaçonave ficasse saturada do gás carbônico (CO2), exalado pela própria equipe. Isso causaria diminuição do pH do sangue da tripulação (acidemia sanguínea), já que o CO2 é um óxido ácido e, em água, ele forma ácido carbônico: CO2 (g) + H2O (l) g → H2CO3 (aq).
A acidemia sanguínea deve ser evitada a qualquer custo. Inicialmente, ela leva a pessoa a ficar desorientada e a desmaiar, podendo evoluir até o coma ou mesmo a morte.
Normalmente, a presença de CO2 na atmosfera da nave não é problema, pois existem recipientes, adaptados à ventilação com hidróxido de lítio (LiOH), uma base capaz de absorver esse gás. Nada quimicamente mais sensato: remover um óxido ácido lançando mão de uma base, através de uma reação de neutralização.
Dados: Massa Molar: O = 16 g/mol
Experi- [NO]0 (mol.L-1 ) [O2]0 (mol.L-1 ) Velocidade da reação Temperatura(ºC) mento (mol.L-1 .s-1 ) 1 0,020 0,010 1,0 . 10-4 400 2 0,040 0,010 4,0 . 10-4 400 3 0,020 0,040 4,0 . 10-4 400 4 0,020 0,040 16,0 . 10-4 ???
Analisando a tabela, é correto afirmar que



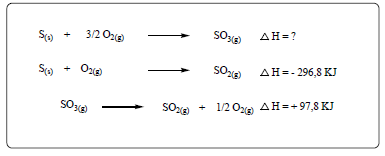
Com base nos dados da tabela, pode-se afirmar que apenas
I. O raio do Li+ é menor do que o raio do Li, pois o primeiro apresenta um elétron a menos. II. Os íons Na+, F– e Mg²+ têm a mesma configuração eletrônica, porém, seus raios são diferentes porque eles têm diferentes números atômicos. III. O raio dos ânions é maior do que o raio dos átomos originais devido ao aumento do número de elétrons na camada de valência dos ânions e aos efeitos de repulsão que os elétrons exercem uns sobre os outros. IV. O raio iônico diminui de cima para baixo em um mesmo grupo na tabela periódica devido ao aumento sucessivo do número de camadas eletrônicas.
Estão corretas as afirmações em
Um químico que trabalha em um laboratório de pesquisa recebeu a estrutura molecular de alguns polímeros como demonstrados abaixo:
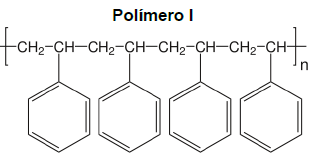
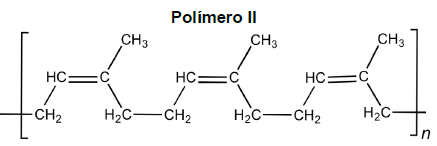
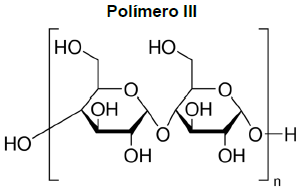
Após analisar as estruturas dessas substâncias, o químico concluiu que os polímeros
I, II e III são solúveis, respectivamente, nos seguintes solventes:
Um aluno mergulhou uma bobina de cobre (6,00 g) em uma solução de nitrato de prata (2,0 g dissolvidos em solução aquosa para 50 mL de volume total). Ele observou, após a ocorrência da reação, a deposição de um sólido acinzentado sobre a bobina de cobre, e também notou que a solução adquiriu uma coloração azul. A massa do sólido cinza foi de 1,2 g e a massa da bobina 5,50 g. As equações abaixo podem ser utilizadas para descrever a reação que ocorre no experimento:
Cu2+(aq) + 2e- → Cu(s) Eº = +0,52 V
Ag+ (aq) + e- → Ag(s) Eº = +0,80 V
2Ag+ (aq) + Cu(s) → 2Ag(s) + Cu2+(aq)
Analise as proposições em relação às informações e às equações acima.
I. A concentração da solução de nitrato de prata é 0,2 mol/L
II. Essa reação pode ser considerada uma pilha com um ΔEº = 0,28 V.
III. A prata oxida nessa reação.
IV. O sólido que se deposita sobre a bobina de cobre é de prata metálica.
V. O cobre é o agente redutor, sofrendo redução.
VI. A quantidade de prata produzida (sólido cinza) foi de 0,011 mol e a quantidade de cobre consumida 0,0079 mol.
Assinale a alternativa correta
O ácido ascórbico, C6H8O6, também conhecido como Vitamina C, é utilizado popularmente por suas propriedades terapêuticas. A vitamina C é comercializada em diversas formas, uma das mais comuns é como comprimidos mastigáveis, que contêm ácido ascórbico na sua composição. Além de ser um ácido, a vitamina C também é um agente redutor. Uma das formas para determinar a quantidade de ácido ascórbico, em uma amostra, é titular com uma solução de bromo, Br2, um agente oxidante, conforme equação química abaixo:
C6H8O6(aq) + Br2(aq) → 2 HBr(aq) + C6H6O6(aq)
Um comprimido, contendo vitamina C em sua composição, possui massa total (vitamina C + excipientes) 1,00 g e requer 20,00 mL de uma solução de bromo, preparada solubilizando 2,25 g de bromo em 100 mL de solução aquosa.
Com base nas informações acima e na equação química, assinale a alternativa que apresenta a concentração da solução de bromo preparada e a massa de vitamina C contida no comprimido.
O “galinho do tempo” é um objeto típico de Portugal muito vendido como lembrança desse país. Esse souvenir muda de cor reversivelmente entre rosa e azul, de acordo com a variação climática do local (temperatura e umidade do ar), devido à presença do composto químico cloreto de cobalto nesse objeto. A reação química que ocorre é demonstrada pela equação química abaixo:
Considerando o equilíbrio químico envolvido na reação química que ocorre no “galinho do tempo”, analise as proposições.
I. Quando a temperatura do local onde o “galinho do tempo” se encontra for elevada, a coloração dele será azul.
II. O “galinho do tempo” apresentará coloração rosa quando a umidade do ar for elevada.
III. Em dias frios e chuvosos, a coloração do “galinho do tempo” será rosa.
Assinale a alternativa correta
O elemento químico arsênio (As) é um metaloide encontrado naturalmente no meio ambiente, sendo as erupções vulcânicas uma de suas principais fontes. Dentre os diversos minerais que contêm arsênio, a arsenopirita (FeAsS) é o mais comum. Esse elemento também pode ser encontrado em alimentos como peixes e crustáceos, e também na cerveja e no vinho branco. Porém, a maior contaminação no homem ocorre por ingestão de água contaminada. Compostos de arsênio foram amplamente utilizados na agricultura como pesticidas. No ramo da medicina veterinária é utilizado como antiparasitário e como aditivo em ração animal. Seu uso também está presente nas indústrias de eletrônicos, como clarificador de vidros e na conservação da madeira.
Analise as afirmativas em relação às informações, no quadro acima.
I. O elemento arsênio pode apresentar estados de oxidação +3 e -3.
II. O raio atômico do elemento arsênio é maior do que o elemento alumínio.
III. O elemento arsênio pode realizar três ou cinco ligações covalentes.
Assinale a alternativa correta.
A nitroglicerina - C3H5(NO3)3 – é um nitrato de alquila, descoberta em 1847 por Ascanio Sobrero (químico italiano, 1812-1888), que a obteve misturando glicerina, ácido nítrico e ácido sulfúrico. No estado puro e à temperatura ambiente, a nitroglicerina é um líquido muito explosivo e perigoso. Em 1867, Alfred Nobel (químico sueco, 1833-1896) realizou testes no sentido de melhorar a manipulação da nitroglicerina, misturando-a com materiais inertes, como sílica, pós cerâmicos, argila, gesso, carvão e terras diatomáceas. Esses materiais, agora moldáveis, viriam a se tornar um explosivo muito importante, conhecido como dinamite.
A equação abaixo (não balanceada) representa a reação de decomposição da nitroglicerina:
C3H5(NO3)3(l) → N2(g) + O2(g) + CO2(g) + H2O(g) (não balanceada)
Dados: ∆Hf C3H5(NO3)3(l) = -364 kJ/mol; ∆Hf CO2(g) = -393 kJ/mol; ∆Hf H2O(g)= -242 kJ/mol
De posse das informações, assinale a alternativa que representa a variação de entalpia da reação acima, em kJ por mol de nitroglicerina.
Considere as três soluções aquosas abaixo:
(1) Al(NO3)3 0,10 mol/L (2) FeCl2 0,133 mol/L (3) Na2SO4 0,300 mol/L
Assinale a alternativa que representa as informações corretas acerca das temperaturas de ebulição das soluções.
Em 1915, o exército alemão utilizou, pela primeira vez, bombas de gás cloro contra trincheiras francesas e argelinas, causando a morte em mais de 5 mil soldados. O cloro gasoso pode ser utilizado na fabricação de solventes clorados, inseticidas (DDT), purificação de água, produção de compostos inorgânicos como hipoclorito de sódio (NaOCl), cloretos metálicos. Uma forma de produzir cloro gasoso em pequenas quantidades é pela reação entre permanganato de potássio e ácido clorídrico, apresentada a seguir:
KMnO4 (s) + HCl (aq) → KCl (aq) + MnCl2 (aq) + Cl2 (g) + H2O (l)
Sobre essa reação, analise as proposições.
I. Trata-se de uma reação de oxirredução, em que o cloreto sofre oxidação e o manganês sofre redução.
II. A reação está balanceada.
III. A reação não está balanceada, sendo os coeficientes estequiométricos para essa reação 2:16:2:2:5:8.
IV. O estado de oxidação do átomo de manganês passa de 7+ para 2+, nessa reação, tratando-se de uma redução.
V. O cloreto é o agente redutor nesta reação.
Assinale a alternativa correta.
Analise o Quadro que apresenta o número de prótons, elétrons e nêutrons de quatro espécies químicas.
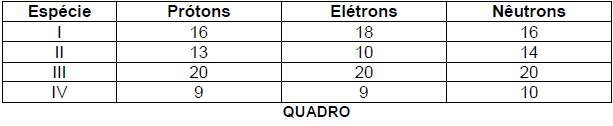
Considerando os dados apresentados no Quadro e de acordo com a Tabela Periódica, assinale
a alternativa incorreta.
