Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Em um funil de separação, encontram-se, em contato, volumes iguais de duas soluções: uma solução aquosa de I2, de concentração 0,1 x 10-3 mol/L, e uma solução de I2 em CCl4, de concentração 1,0 x 10-3 moI/L.
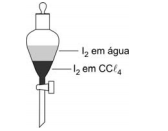
Considere que o valor da constante Kc do equilíbrio
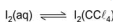
é igual a 100, à temperatura do experimento, para concentrações expressas em moI/L.
Assim sendo, o que é correto afirmar a respeito do
sistema descrito?
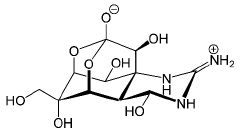
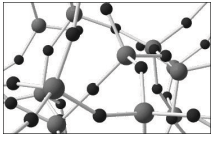 A substância representada por esse modelo
tridimensional pode ser
A substância representada por esse modelo
tridimensional pode ser Considere 4 frascos, cada um contendo diferentes substâncias, a saber:
Frasco 1: 100 mL de H2O(l)
Frasco 2: 100 mL de solução aquosa de ácido acético de concentração 0,5 mol/L
Frasco 3: 100 mL de solução aquosa de KOH de concentração 1,0 mol/L
Frasco 4: 100 mL de solução aquosa de HNO3 de concentração 1,2 mol/L
A cada um desses frascos, adicionaram-se, em experimentos distintos, 100 mL de uma solução aquosa de HCl de concentração 1,0 moI/L. Medindo-se o pH do líquido contido em cada frasco, antes e depois da adição de HCl(aq), pôde-se observar aumento do valor do pH somente
I. É solúvel em água.
II. Sua solução aquosa é condutora de corrente elétrica.
III. Quando puro, o sólido não conduz corrente elétrica.
IV. Quando fundido, o líquido puro resultante não conduz corrente elétrica.
Considerando essas informações, o sólido em questão pode ser
NOTE E ADOTE As porcentagens aproximadas dos isótopos 238U e 235U existentes em uma amostra de urânio natural são, respectivamente, 99,3% e 0,7%.
Sem dúvidas, o maior crescimento do feto ocorre durante o último trimestre de gestação; seu peso quase duplica durante os últimos 2 meses de gestação. Comumente, a mãe não absorve proteínas, cálcio, fosfatos e ferro suficientes pela dieta, durante os últimos meses de gestação para suprir essas necessidades extras do feto. Entretanto, antecipando essas necessidades extras, o corpo da mãe já armazenou essas substâncias – parte na placenta, mas a maioria nos depósitos normais da mulher. Se os elementos nutricionais apropriados não estiverem presentes na dieta da gestante, pode ocorrer uma série de deficiências maternas, especialmente de cálcio, fosfatos, ferro e vitaminas. Por exemplo, o feto precisa de cerca de 375 miligramas de fero para formar seu sangue, e a mãe precisa de outros 600 miligramas para formar seu próprio sangue extra. A reserva normal de ferro não ligado à hemoglobina na mulher, no início da gravidez, geralmente fica em torno de 100 miligramas e quase nunca acima de 700 miligramas. Por isso, sem ferro suficiente na dieta, a gestante muitas vezes desenvolve anemia hipocrômica.
JOHN E. HALL. Tratado de fisiologia médica. 12º ed Rio de Janeiro: Elsevier, 2011.
Na profilaxia e tratamento da anemia hipocrômica, normalmente são utilizados medicamentos à base de Ferro. Num dos mais comuns, o ferro apresenta-se na forma de “ferro aminoácido quelato”, fórmula química C4H8N2O4Fe. Quantos milimols de ferro ao dia um paciente que utilize diariamente a posologia de 265mg do medicamento ingere? (Dados: C = 12,0 g/mol; H = 1,0 g/mol; N = 14,0 g/mol; O = 16,0 g/mol; Fe = 53,0 g/mol)
Da forma semelhante a outros óxidos, o SO2 reage com a água formando o ácido sulfuroso: SO2 (g) + H2O (l) → H2SO3 (aq) H2SO3 (aq) → H+ (aq) + HSO3- (aq)
O SO2 pode ainda sofrer oxidação na atmosfera e formar o trióxido de enxofre (SO3), o qual, por sua vez, em contato com a água da chuva, formará o ácido sulfúrico (H2SO4), que é um ácido forte. SO2 (g) + ½ O2 (g) → SO3 (g) SO3 (g) + H2O (l) → H2SO4 (aq) H2SO4 (aq) → 2H+ (aq) + SO4 2- (aq)
Assumindo que a fórmula química do carvão é C135H96O9NS e que uma usina termelétrica movida a carvão queima cerca de 2,74 x 106 kg de carvão por dia, a quantidade em mols de SO2 despejados na atmosfera durante a queima deste carvão, em um dia normal, é (Dados: S = 32,0 g/mol; C = 12,0 g/mol; H = 1,0 g/mol; O = 16 g/mol; N = 14 g/mol)
As minas de columbita e tantalita, minérios que produzem o composto coltan, exterminaram a maioria da população de gorilas e elefantes da República Democrática do Congo. Sua produção envolve, além da matança de animais, profunda exploração humana e ambiental. O coltan é um mineral importante para a fabricação de celulares, TVs de plasma, notebooks, câmeras digitais, satélites artificiais e diversas outras tecnologias. E suas matérias-primas, columbita e tantalita, têm seu maior foco de extração na África, que corresponde a 80% de todo o coltan utilizado pelas indústrias eletroeletrônicas do mundo. Os métodos de extração são rudimentares e promovem profunda exploração humana. São camponeses, prisioneiros de guerra, refugiados de guerra e crianças que extraem columbita e tantalita, sempre vigiados por militares. Os resultados são a vedação do direito das crianças à escola, mortes por desabamentos de túneis, doenças por falta de água limpa, saneamento e alimento, a disputa de grupos armados por cada mina, mortes de crianças (estima-se que cada quilo de coltan implicou a morte de duas crianças), transformação de bosques e campos agrícolas em lodaçais, desalojamentos forçados, violação de mulheres e meninas etc. As consequências ambientais também são alarmantes: para a extração de coltan, invadiram parques ecológicos nacionais da República Democrática do Congo, e matou-se 80% da população de elefantes e 90% da de gorilas do país, levando sua população quase à extinção local. Afirma-se que a maioria das multinacionais fabricantes de celulares está envolvida na compra do coltan congolês e na manutenção de governos corruptos e de guerras pela extração das matérias-primas desse mineral. O coltan é um exemplo gritante de como o capitalismo passa por cima da dignidade humana e da vida animal para o almejamento do lucro e do atendimento de “necessidades” não tão necessárias e de como a indústria corporativa de hoje não tem qualquer senso de responsabilidade socioambiental, nem mesmo de respeito à vida. Na impossibilidade de um boicote total às empresas compradoras do coltan congolês, vale as pessoas tentarem comprar o mínimo possível de eletroeletrônicos portáteis, pelo bem dos animais humanos e não humanos que vêm sendo explorados e massacrados na República Democrática do Congo.
SOUZA, ROBSON FERNANDO. Minas de coltan mataram maioria dos elefantes e gorilas do Congo. Disponível em:. Acesso:<http://www.anda.jor.br/21/06/2012/minas-de-coltan-mataram-maioria-dos-elefantes-e-gorilas-do-congo> 01 maio 2017.
A columbita, um mineral rico em nióbio, possui a fórmula molecular FeNb2O6 e faz parte da pauta de exportação mineral do Brasil, tendo sido exportadas, no ano de 2012 cerca de 71 mil toneladas do minério. A quantidade de nióbio exportada pelo Brasil em 2012 foi de, aproximadamente, (Dados: Fe= 56 g/mol, Nb=93 g/mol e O=16,0 g/mol).
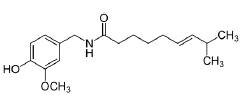
Em relação à capsaicina, a reação de oxidação branda da dupla ligação - E - leva à formação de




















Massa molar do NaHCO3 = 84 g/mol Constante de Avogadro: 6 × 1023 mol–1
A equação química que representa a reação que ocorre na fermentação alcoólica da glicose é
C6H12O6(aq) → 2 C2H6O(aq) + 2 CO2(g) ΔrH = ?
Assinale a alternativa que apresenta o valor correto da entalpia padrão da reação (ΔrH) de fermentação da glicose, em kJ/mol.
Entalpias de formação em kJ/mol
Substância ΔfH C6H12O6(aq) – 1 277 C2H6O (aq) – 278 CO2(g) – 394
A força dos ácidos pode ser considerada como um parâmetro que mede a quantidade de íons H+ liberados para solução quando diluídos em água.
Sobre a força dos ácidos, o grau de ionização e o cálculo do pH, relacione a coluna da esquerda com a da direita.
(I) CH3COOH (Ka = 1,80×10−5 ) (II) HCℓ (Ka = 1,00×107) (III) HF (Ka = 6,70×10−4) (IV) HCN (Ka = 4,90×10−10) (V) HNO2 (Ka = 6,09×10−6)Assinale a alternativa que contém a associação correta.
As ligações químicas realizadas entre átomos conferem às subtâncias diferentes propriedades químicas e físicas.
Sobre os tipos de ligações, assinale a alternativa que apresenta, correta e respectivamente, as ligações químicas nas substâncias NaH, FeCℓ3, diamante, Sn (estanho), polietileno e HNO3.
Assinale a alternativa correta.