Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
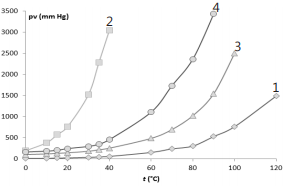
Assinale a alternativa CORRETA:
I. Generalizando, todos os sais de fosfatos (PO4 3- ) são insolúveis; II. O di-hidrogenofosfato de sódio, NaH2 PO4 , é insolúvel; III. O di-hidrogenofosfato de amônio, (NH4 ) 3 PO4 , é solúvel; IV. Generalizando, todos os sais de hidróxidos (OH- ) são insolúveis; V. O hidróxido de sódio, NaOH, é solúvel.
Destas afirmações, estão CORRETAS:
Um estudante gotejou água sobre diferentes tipos de papel e plástico. Ele observou diferenças na velocidade de absorção da água por esses materiais e também verificou que alguns deles não absorvem água.
A seguir apresentamos as estruturas da celulose, do polietileno e da água.
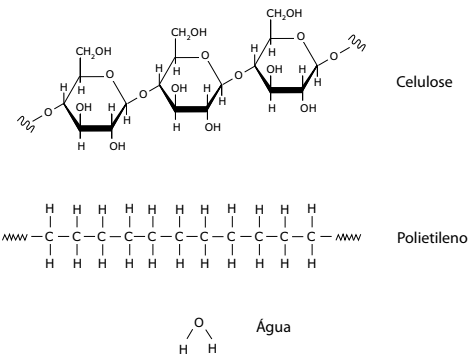
Considerando-se as informações do texto e das estruturas ilustradas, é CORRETO
afirmar que
Para explorar convenientemente a cultura da soja, é indispensável incorporar calcário aos solos que estão com pH inferior a 5,5. A quantidade de calcário a ser aplicada no terreno é determinada através da análise do solo.
Considerando-se essas informações, é INCORRETO afirmar que
O besouro-bombardeiro consegue afastar seus predadores, lançando sobre eles um jato quente e repelente de quinona, substância produzida em seu abdômen, através da reação química entre hidroquinina e peróxido de hidrogênio. O fenômeno pode ser representado pela equação:
C6 H6 O2(aq) + H2O2(aq) → C6 H4O2(aq) + 2H2 O ∆H = –204 kJ/mol
Hidroquinona Quinona
Em 1911, o renomado cientista Ernest Rutherford e seus colaboradores Marsden e Geiger realizaram uma série de experimentos com materiais que emitiam partículas alfa (α). Os resultados obtidos levaram esse pesquisador a sugerir um novo modelo para o átomo. A figura a seguir representa, esquematicamente, um desses experimentos.
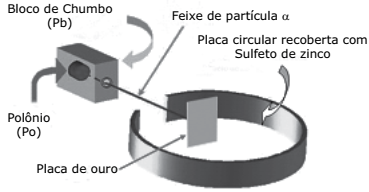
Sobre os motivos que levaram Rutherford a realizar esses experimentos e as conclusões que ele obteve, foram feitas as afirmações:
I. Rutherford concordava com o modelo atômico sugerido por Thomson e, por isso, esperava que todas as partículas alfa(α) atravessassem a placa de ouro com facilidade.
II. O modelo atômico proposto por Rutherford sugere que o átomo é eletricamente neutro, apesar de ser constituído por partículas positivas e negativas.
III. Rutherford desenvolveu esses experimentos porque estudava o comportamento dos prótons e elétrons que constituem a placa de ouro.
Assinale a alternativa em que foram apontadas as afirmativas CORRETAS.
Ao ingerirmos fígado de boi, couve ou gemas de ovos, temos uma dieta rica em ferro.
Sobre o ferro, é CORRETO afirmar que
A dehidrohalogenação é um exemplo de reação de eliminação que ocorre entre um composto orgânico e uma base forte. Nesse processo químico, retira-se um átomo de halogênio ligado a um dos átomos de carbono. O átomo de carbono adjacente ao átomo de carbono halogenado “perde” um átomo de hidrogênio, estabelecendo entre os dois átomos de carbono considerados uma ligação dupla.
A reação entre o hidróxido de sódio e o cloroetano ilustrada é um exemplo de dehidrohalogenação.
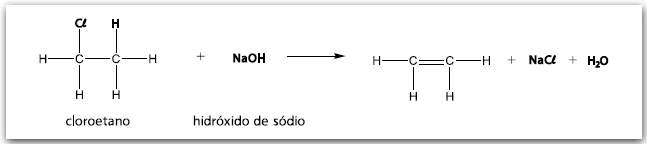
Agora, considere a reação entre o 1–clorobutano e o hidróxido de potássio.
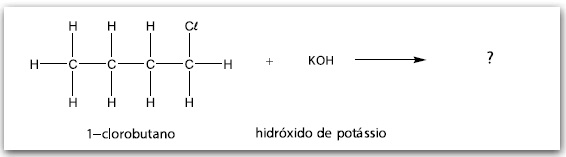
Assinale a alternativa que apresenta a fórmula estrutural correta do composto orgânico obtido na reação entre o 1–clorobutano e o hidróxido de potássio, representada na figura.

Durante o funcionamento do circuito, é correto afirmar que ocorre
NH3(g) + H2O ( l ) NH+4(aq) + OH–(aq) ∆H0 < 0
Segundo a teoria proposta por Arrhenius, a solução aquosa resultante da dissolução da amônia em água é classificada como
Massas molares em g/mol: C = 12,0 N = 14,0 O = 16,0 Na = 23,0 Cl = 35,5
Albert Henne nasceu em Bruxelas, Bélgica, em 1901. Ele mudou-se para os Estados Unidos em 1925 e tornou-se um cidadão naturalizado em 1933.
Em 1930, Henne e o engenheiro mecânico Thomas Midgley Jr, sintetizaram várias moléculas diferentes contendo um ou dois átomos de carbono, pelo menos um átomo de flúor e pelo menos um átomo de cloro. Os compostos resultantes, os clorofluorcarbonetos (ou CFCs, como hoje são conhecidos), apresentaram todas as características de gases refrigerantes.
(Fonte dos dados: BURRESON, J. e LE COUTEUR, P. Os botões de Napoleão. Rio de Janeiro: ZAHAR, 2006.)
Assinale a alternativa que apresenta uma molécula que possui as características de um CFC, conforme a descrição apresentada no texto.
Este composto também pode ser preparado a partir de uma reação de esterificação:
CH3 –CH2 –OH (l) + CH3 –COOH (l) CH3 ⇌ COOCH2 –CH3 (l) + H2O (l)
Para calcularmos a variação de entalpia da reação, ∆H, podemos aplicar a lei de Hess às equações de combustão dos compostos orgânicos presentes na reação de esterificação, apresentadas a seguir.
I. CH3–CH2 –OH (l) + 3 O2 (g) ⇾ 2 CO2 (g) + 3 H2O (l) ∆H = – 1 368 kJ II. CH3COOH (l) + 2 O2 (g) ⇾ 2 CO2 (g) + 2 H2O (l) ∆H = – 875 kJ III. CH3COOCH2CH3 (l) + 5 O2 (g) ⇾ 4 CO2 (g) + 4 H2O (l) ∆H = – 2 231 kJ
Aplicando a lei mencionada, a variação de entalpia da reação de esterificação descrita será, em kJ, igual a

Para isso, devemos reagir o ácido etanoico com

A produção da essência de maçã-verde pode ser favorecida pelo deslocamento desse equilíbrio por meio
Leia o texto para responder à questão.
“Houston, we have a problem”. Ao enviar essa mensagem, em 13 de abril de 1970, o comandante da missão espacial Apollo 13 sabia que sua vida e as dos seus dois companheiros estavam por um fio. Um dos tanques de oxigênio (O2 ) tinha acabado de explodir. Apesar do perigo iminente dos astronautas ficarem sem O2 para respirar, a principal preocupação da NASA era evitar que a atmosfera da espaçonave ficasse saturada do gás carbônico (CO2), exalado pela própria equipe. Isso causaria diminuição do pH do sangue da tripulação (acidemia sanguínea), já que o CO2 é um óxido ácido e, em água, ele forma ácido carbônico: CO2 (g) + H2O (l) g → H2CO3 (aq).
A acidemia sanguínea deve ser evitada a qualquer custo. Inicialmente, ela leva a pessoa a ficar desorientada e a desmaiar, podendo evoluir até o coma ou mesmo a morte.
Normalmente, a presença de CO2 na atmosfera da nave não é problema, pois existem recipientes, adaptados à ventilação com hidróxido de lítio (LiOH), uma base capaz de absorver esse gás. Nada quimicamente mais sensato: remover um óxido ácido lançando mão de uma base, através de uma reação de neutralização.
