Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
As propriedades físico-químicas das substâncias são afetadas pelas interações intra e intermoleculares.
Com base nos conhecimentos de química e nos dados da tabela, é correto afirmar:
A geometria da molécula do SF6 é octaédrica.
As propriedades físico-químicas das substâncias são afetadas pelas interações intra e intermoleculares.
Com base nos conhecimentos de química e nos dados da tabela, é correto afirmar:
O SO2 é uma molécula apolar, pois possui geometria linear.
C6H4(OH)2(aq) + H2O2
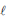 ) hidroquinona
) hidroquinona O calor envolvido nessa transformação pode ser calculado, considerando-se os processos:
C6H4(OH)2(aq) → C6H4O2(aq) + H2(g) ΔHº = + 177 kJ . mol-1
H2O (
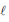 ) + 1/2 O (g) → H2O2 (aq) ΔHº= + 95 kJ .mol-1
) + 1/2 O (g) → H2O2 (aq) ΔHº= + 95 kJ .mol-1
H2O(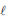 ) → 1/2 O2(g) + H2 (g) ΔHº= + 286 kJ .mol-1
) → 1/2 O2(g) + H2 (g) ΔHº= + 286 kJ .mol-1

A ordem dessas transformações, da pior para a melhor, de acordo com a “Química Verde”, é:
Em um experimento, alunos associaram os odores de alguns ésteres a aromas característicos de alimentos, como, por exemplo:

Analisando a fórmula estrutural dos ésteres apresentados,
pode-se dizer que, dentre eles, os que têm cheiro de
Sob condições adequadas, selênio (Se) e estanho (Sn) podem reagir, como representado pela equação
2 Se + Sn → SnSe2
Em um experimento, deseja-se que haja reação completa,
isto é, que os dois reagentes sejam totalmente
consumidos. Sabendo-se que a massa molar do selênio
(Se) é 2/3 da massa molar do estanho (Sn), a razão entre
a massa de selênio e a massa de estanho (mSe : mSn), na
reação, deve ser de
A + B
 P
P
Após uma série de quatro experimentos, o estudante representou os dados obtidos em uma tabela:
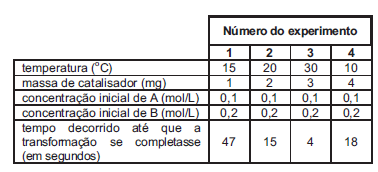
Que modificação deveria ser feita no procedimento para obter resultados experimentais mais adequados ao objetivo proposto?
Uma estudante de química realizou quatro experimentos, que consistiram em misturar soluções aquosas de sais inorgânicos e observar os resultados. As observações foram anotadas em uma tabela:
Experimento Solutos contidos inicialmente Observações
nas soluções que foram misturadas
1 Ba(C O3)2 Mg(IO3)2
formação de
precipitado branco
O3)2 Mg(IO3)2
formação de
precipitado branco
2 Mg(IO3)2 Pb(C O3)2 formação de
precipitado branco
O3)2 formação de
precipitado branco
3 MgCrO4 Pb(C O3)2 formação de
precipitado amarelo
O3)2 formação de
precipitado amarelo
4 MgCrO4 Ca(C O3)2 nenhuma transformação observada
O3)2 nenhuma transformação observada
A partir desses experimentos, conclui-se que são pouco
solúveis em água somente os compostos
As figuras a seguir representam, de maneira simplificada, as soluções aquosas de três ácidos, HA, HB e HC, de mesmas concentrações. As moléculas de água não estão representadas.
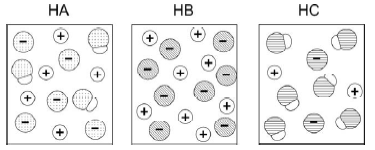
Considerando essas representações, foram feitas as seguintes afirmações sobre os ácidos:
I. HB é um ácido mais forte do que HA e HC.
II. Uma solução aquosa de HA deve apresentar maior condutibilidade elétrica do que uma solução aquosa de mesma concentração de HC.
III. Uma solução aquosa de HC deve apresentar pH maior do que uma solução aquosa de mesma concentração de HB.
Está correto o que se afirma em
Na produção de combustível nuclear, o trióxido de urânio é transformado no hexafluoreto de urânio, como representado pelas equações químicas:
I. UO3(s) + H2(g) → UO2(s) + H2O(g)
II. UO2(s) + 4 HF(g) → UF4 (s) + 2 H2O(g)
III. UF4(s) + F2(g) → UF6 (g)
Sobre tais transformações, pode-se
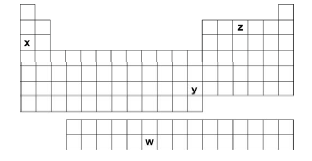
Considerando suas posições na Tabela Periódica, assinale a alternativa que melhor associa esses quatro elementos químicos com as propriedades discutidas acima.
Em 1859, surgiram experimentos para a construção de uma bateria para acumular energia elétrica, as baterias de chumbo, que passando por melhorias ao longo dos tempos, tornaram-se um grande sucesso comercial especialmente na indústria de automóveis.
Essas baterias são construídas com ácido sulfúrico e amálgamas de chumbo e de óxido de chumbo IV, em caixas confeccionadas com o polímero polipropileno.
<http://tinyurl.com/n6byxmf>Acesso em: 10.04.2015. Adaptado.
O monômero usado na produção desse polímero é o
Em 18 de Fevereiro de 2015, o Google Doodle fez uma homenagem ao 270o aniversário do inventor da pilha elétrica, Alessandro Volta, um físico italiano que tinha como uma de suas paixões a eletricidade. A unidade elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve grande importância no que diz respeito à pilha elétrica.

<http://tinyurl.com/m5dagtf> Acesso em: 20.02.2015. Adaptado. Original colorido.
Na imagem, podemos observar uma pilha e duas semirreações que representam os processos de oxidação e de redução,
envolvidos na confecção dessa pilha, cujos potenciais padrão de redução são:
I. Zn2+/Zn: - 0,76 V
II. 2H+/H2 : 0,00 V
Um dos materiais usados na confecção da pilha é o zinco, cujo símbolo é Zn e apresenta
• Número atômico: 30
• Massa atômica: 65,4 u
• Ponto de fusão: 419,5 °C
• Ponto de ebulição: 907 °C
• Configuração por camadas:
K L M N
2 8 18 2
A imagem apresenta duas semirreações, sendo uma de um elemento não metálico. Dada a fila de reatividade de metais:
alcalinos>alcalinoterrosos>Al>Zn>Fe>H2>Cu>Ag>Pt>Au
é correto afirmar que, a substância simples desse elemento pode ser obtida por meio da reação de
Em 18 de Fevereiro de 2015, o Google Doodle fez uma homenagem ao 270o aniversário do inventor da pilha elétrica, Alessandro Volta, um físico italiano que tinha como uma de suas paixões a eletricidade. A unidade elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve grande importância no que diz respeito à pilha elétrica.

<http://tinyurl.com/m5dagtf> Acesso em: 20.02.2015. Adaptado. Original colorido.
Na imagem, podemos observar uma pilha e duas semirreações que representam os processos de oxidação e de redução,
envolvidos na confecção dessa pilha, cujos potenciais padrão de redução são:
I. Zn2+/Zn: - 0,76 V
II. 2H+/H2 : 0,00 V
Um dos materiais usados na confecção da pilha é o zinco, cujo símbolo é Zn e apresenta
• Número atômico: 30
• Massa atômica: 65,4 u
• Ponto de fusão: 419,5 °C
• Ponto de ebulição: 907 °C
• Configuração por camadas:
K L M N
2 8 18 2
Em 18 de Fevereiro de 2015, o Google Doodle fez uma homenagem ao 270o aniversário do inventor da pilha elétrica, Alessandro Volta, um físico italiano que tinha como uma de suas paixões a eletricidade. A unidade elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve grande importância no que diz respeito à pilha elétrica.

<http://tinyurl.com/m5dagtf> Acesso em: 20.02.2015. Adaptado. Original colorido.
Na imagem, podemos observar uma pilha e duas semirreações que representam os processos de oxidação e de redução,
envolvidos na confecção dessa pilha, cujos potenciais padrão de redução são:
I. Zn2+/Zn: - 0,76 V
II. 2H+/H2 : 0,00 V
Um dos materiais usados na confecção da pilha é o zinco, cujo símbolo é Zn e apresenta
• Número atômico: 30
• Massa atômica: 65,4 u
• Ponto de fusão: 419,5 °C
• Ponto de ebulição: 907 °C
• Configuração por camadas:
K L M N
2 8 18 2
Em 18 de Fevereiro de 2015, o Google Doodle fez uma homenagem ao 270o aniversário do inventor da pilha elétrica, Alessandro Volta, um físico italiano que tinha como uma de suas paixões a eletricidade. A unidade elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve grande importância no que diz respeito à pilha elétrica.

<http://tinyurl.com/m5dagtf> Acesso em: 20.02.2015. Adaptado. Original colorido.
Na imagem, podemos observar uma pilha e duas semirreações que representam os processos de oxidação e de redução,
envolvidos na confecção dessa pilha, cujos potenciais padrão de redução são:
I. Zn2+/Zn: - 0,76 V
II. 2H+/H2 : 0,00 V
Um dos materiais usados na confecção da pilha é o zinco, cujo símbolo é Zn e apresenta
• Número atômico: 30
• Massa atômica: 65,4 u
• Ponto de fusão: 419,5 °C
• Ponto de ebulição: 907 °C
• Configuração por camadas:
K L M N
2 8 18 2
Independentemente do tipo de atividade exercida em um laboratório químico, são diversos os riscos existentes nesse ambiente de trabalho, entre os quais podemos citar os riscos químicos.
“Risco Químico é o perigo a que determinado indivíduo está exposto ao manipular produtos químicos que podem causar-lhe danos físicos ou prejudicar-lhe a saúde. Os danos físicos relacionados à exposição química incluem, desde irritação na pele e olhos, passando por queimaduras leves, indo até aqueles de maior severidade, causados por incêndio ou explosão. Os danos à saúde podem advir de exposição de curta e/ou longa duração, relacionada ao contato de produtos químicos tóxicos com a pele e olhos, bem como à inalação de seus vapores, resultando em doenças respiratórias crônicas, doenças do sistema nervoso, doenças nos rins e fígado e, até mesmo, alguns tipos de câncer.”
<http://tinyurl.com/lfezqwg>Acesso em: 17.04.2015.
A tabela a seguir apresenta algumas substâncias orgânicas muito empregadas em laboratórios de Química. As substâncias listadas são empregadas como solventes ou reagentes específicos.
Identificação Compostos
1 Ácido propanóico
2 Propan-1-ol
3 Etanoato de metila
4 Propan-2-ol
Como relação aos compostos listados, na tabela acima, assinale a alternativa VERDADEIRA.
As propriedades dos compostos químicos são funções das ligações entre os átomos formadores da molécula, da geometria e da polaridade molecular. Com relação aos compostos: CO2, SO2, CH4, NaBr e HF, verifique as proposições abaixo.
I. O CO2 é uma molécula linear e polar.
II. O SO2 é uma molécula angular e polar.
III.O CH4 é uma molécula piramidal e apolar.
IV.O NaBr é um composto iônico.
V. O HF é uma molécula que apresenta pontes de hidrogênio.
São verdadeiras, apenas, as proposições
