Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
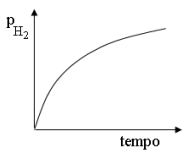
Considerando que a reação envolvida na reforma a vapor do metano apresente cinética de primeira ordem em relação ao metano, assinale a opção em que é apresentado gráfico que melhor representa a variação da pressão parcial de H2 no sistema em função do tempo de reação.

No processo de reforma a vapor do metano, a separação do H2 a partir da mistura reacional pode ser realizada facilmente porque, após o resfriamento do sistema, a água condensará e solubilizará o H2, devido à formação de ligações de hidrogênio entre as moléculas de H2O e H2; após a remoção dos gases não dissolvidos, o H2 dissolvido na água pode ser liberado por meio de um aquecimento brando da mistura.

Considerando-se que os valores de Ho lig apresentados são válidos para as condições em que a reforma a vapor do metano esteja sendo realizada, conclui-se que a entalpia padrão da reação, conforme apresentada, é superior a 300 kJ/mol.
A partir do texto precedente e considerando que as entalpias de combustão do metano e do 2,2,4-trimetilpentano sejam respectivamente iguais a 890 kJ/mol e 5.464 kJ/mol, julgue o item subsequente.
A eventual substituição do 2,2,4-trimetilpentano por metano como combustível, admitindo-se combustão completa, permitiria uma redução superior a 20% na quantidade de CO2 liberada para a mesma quantidade de energia gerada.
A partir do texto precedente e considerando que as entalpias de combustão do metano e do 2,2,4-trimetilpentano sejam respectivamente iguais a 890 kJ/mol e 5.464 kJ/mol, julgue o item subsequente.
As moléculas de SO2 são polares, ao passo que as de CO2 são apolares; essa diferença de comportamento pode ser relacionada ao fato de que, no CO2, todos os elétrons de valência do carbono são envolvidos nas ligações covalentes com os átomos de oxigênio, enquanto, no SO2, existe um par de elétrons não ligantes em torno do átomo de enxofre.
A partir do texto precedente e considerando que as entalpias de combustão do metano e do 2,2,4-trimetilpentano sejam respectivamente iguais a 890 kJ/mol e 5.464 kJ/mol, julgue o item subsequente.
O 2,2,4-trimetilpentano é isômero do 1,4-dimetilbenzeno.
A partir do texto precedente e considerando que as entalpias de combustão do metano e do 2,2,4-trimetilpentano sejam respectivamente iguais a 890 kJ/mol e 5.464 kJ/mol, julgue o item subsequente.
A fórmula estrutural do 2,2,4-trimetilpentano é corretamente representada na figura a seguir.
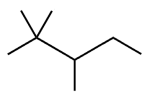
A partir do texto precedente e considerando que as entalpias de combustão do metano e do 2,2,4-trimetilpentano sejam respectivamente iguais a 890 kJ/mol e 5.464 kJ/mol, julgue o item subsequente.
O metano é uma molécula polar porque, como possui geometria tetraédrica, a resultante da soma dos vetores de momento de dipolo das quatro ligações C_H é diferente de zero.
Sabendo-se que a solubilidade do SO2 em água é de 228 g/L a 20 °C, ainda que todo o SO2 atmosférico seja convertido em H2SO4 por meio das reações apresentadas no texto, a concentração de H2SO4 na água da chuva jamais superará o valor de 3,0 mol/L.
O H2SO4 é capaz de diminuir o pH da água da chuva porque reage com a água, em uma reação chamada hidrólise, que gera o íon hidrônio (H3O+ ) em solução aquosa; essa reação está corretamente descrita na equação a seguir, em que o H2SO4 atua como um ácido de Brønsted-Lowry e a água, como uma base de Brønsted-Lowry.
H2SO4 (aq) + H2O (l) → H3O+ (aq) + HSO4 − (aq)
A molécula de trióxido de enxofre (SO3) possui geometria espacial do tipo piramidal, já que o átomo de enxofre (S) apresenta um par de elétrons não ligantes ocupando um orbital que faz um ângulo de 109º28’ com as ligações covalentes com os átomos de oxigênio (O).
A velocidade de conversão de SO2 atmosférico em SO3 é diretamente proporcional à concentração do radical hidroxilo na atmosfera.
No meio atmosférico, ocorrem numerosas reações que reduzem o enxofre do estado de oxidação +6 para o estado de oxidação +4, o que leva à formação de ácido sulfúrico (H2SO4), um dos ácidos mais fortes conhecidos.
Tendo o texto precedente como referência inicial, julgue o item subsequentes, relativos aos compostos orgânicos e suas reações.
A reação de adição de água, ou hidratação, permite a obtenção de éteres a partir de alcenos.
Tendo o texto precedente como referência inicial, julgue o item subsequentes, relativos aos compostos orgânicos e suas reações.
Na reação de alquilação, um grupo alquila (R-CO-), derivado de um ácido carboxílico, é introduzido em uma molécula.
Tendo o texto precedente como referência inicial, julgue o item subsequentes, relativos aos compostos orgânicos e suas reações.
A reação de substituição que ocorre entre um alcano (o metano, por exemplo) e um halogênio é denominada halogenação.
Tendo o texto precedente como referência inicial, julgue o item subsequentes, relativos aos compostos orgânicos e suas reações.
A ligação tripla dos alcinos comporta-se como a dupla dos alcenos, ou seja, sofre apenas uma adição.
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
O metano (CH4), gás amplamente utilizado como combustível, tem sido utilizado como uma alternativa de energia mais limpa em comparação a outros hidrocarbonetos mais pesados. A molécula de metano possui geometria
tetraédrica, com ângulos de ligação de aproximadamente 109,5°, e suas forças intermoleculares são do tipo dispersão de London.
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
Assinale a opção em que são apresentadas, respectivamente, as geometrias moleculares dos compostos SO2, CH2O, HCN e NH3.
B angular; trigonal plana; linear; e piramidal
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
O modelo de repulsão dos pares eletrônicos da camada de valência (VSEPR), útil para a determinação da geometria de uma molécula, leva em consideração apenas os pares de elétrons que participam da ligação química.