Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
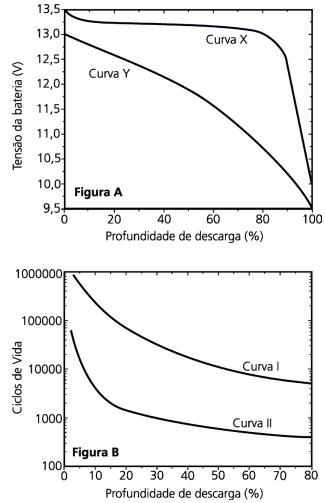
Levando em conta essas informações, seria apropriado escolher para equipar um carro
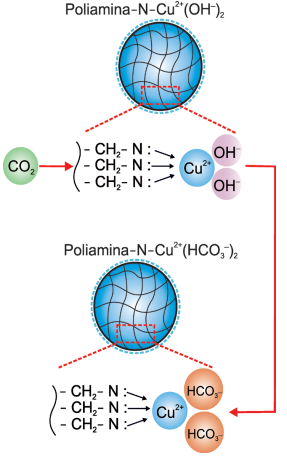
De acordo com os autores do estudo, 1 kg de poliamina contendo cobre é capaz de adsorver até 5 mols de CO2 , uma quantidade bem superior ao que se conhece até então. Com base nessas informações, pode-se concluir que a porcentagem em massa de cobre no sólido é cerca de
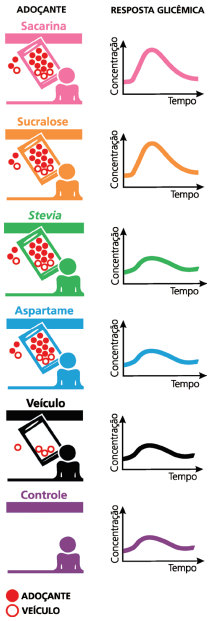
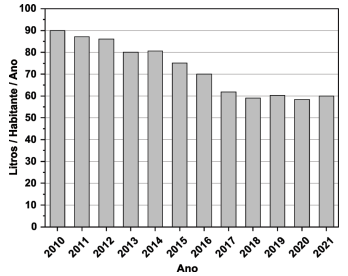
Dados:
i) ingestão total de energia diária para adultos: 8400 kJ (recomendação da OMS).
ii) energia por grama de açúcar: 16,5 kJ.
De acordo com as informações do gráfico e do texto 1, pode-se afirmar que a média de consumo diário de açúcar, por habitante, para cada ano, devido somente à ingestão de refrigerante,
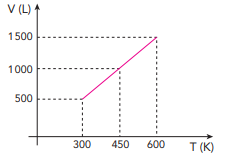
Admita que o processo de expansão volumétrica ocorre à pressão constante de 8 atm e que a constante universal dos gases ideais é de 0,08 atm.L/mol.K. Ao atingir a temperatura máxima, o número de mols da amostra de gás corresponderá a:
CaC2 (s) + 2 H2 O (l) → Ca(OH)2 (aq) + C2 H2 (g)
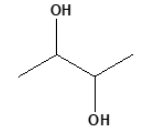
O nome do composto orgânico obtido nessa reação é:
2N α2O2(s) + 2H2O(l) → 4N aOH(s) + O2(g)