Questões de Vestibular Sobre química
Foram encontradas 6.520 questões
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
O número de átomos de cobalto em 235,6 g de cobalto metálico é superior a 2,6 × 1024.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
Conforme o princípio de Le Châtelier, caso a reação esteja em equilíbrio, um aumento na concentração de amônia deslocaria o equilíbrio no sentido da formação do complexo.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
O nitrogênio é mais propenso a formar ligações duplas e triplas que o fósforo, devido ao seu menor raio atômico e à sua maior eletronegatividade.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
O valor da constante de equilíbrio da reação em apreço indica que a decomposição do complexo [Co(NH3)6] 2+ é favorecida.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
Considere que, para a preparação do complexo, seja utilizada uma solução de cloreto de cobalto (II) anidro (CoCl2). Nesse caso, a relação entre o produto de solubilidade (Kps) do CoCl2 e sua solubilidade molar (cs) seriam corretamente representados por
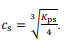
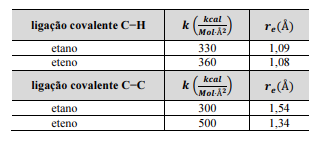
Para a ligação C−H esticada 0,02 Å além da sua distância de equilíbrio, a energia potencial em um eteno será menor que em um etano.

A partir das informações precedentes, julgue o item que se segue.
Para a ligação C−C esticada 0,2 Å além de sua respectiva distâncias de equilíbrio, a força de interação na ligação do eteno é duas vezes mais intensa que na ligação do etano.

A entalpia de vaporização caracteriza-se por ser sempre positiva.

A entalpia de um sistema é uma grandeza, expressa em unidade de energia, que informa a quantidade de energia desse sistema que poderia ser transformada em calor em um processo a pressão constante.

A reação de combustão do gás hidrogênio gera água na forma de vapor; se a reação gerasse água na forma líquida, a liberação de energia seria a mesma.

Reações de combustão são facilmente reversíveis.

A entalpia-padrão de formação (ΔHºf) é nula para substâncias simples, desde que estejam no estado-padrão, no estado físico e na forma alotrópica mais estáveis.

A reação de combustão do gás hidrogênio libera uma quantidade de energia superior a 230 kJ/mol.

A entalpia-padrão de combustão (ΔHºc) pode ser chamada, também, de calor de combustão.
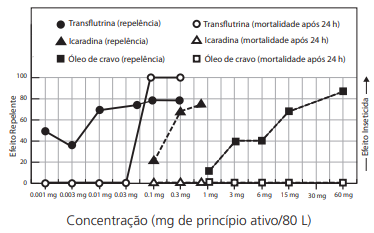
Com base nos resultados experimentais, é correto afirmar que, na faixa considerada,
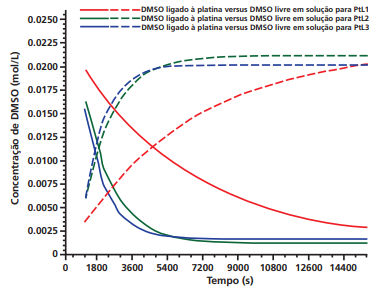
Considerando que quanto menor a velocidade de troca, maior é a eficiência do fármaco, pode-se concluir que
Dado: massa molar do HCl = 36,5 g/mol.
Em vista dessas informações, pode-se concluir que a sustentabilidade do processo de biodigestão da vinhaça in natura é devida à geração de energia renovável a partir da queima do
Considere uma barra de chocolate cujos percentuais de energia sejam os apresentados conforme a tabela a seguir.
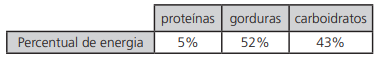
A partir dessas informações, pode-se afirmar que, em comparação com os respectivos percentuais em energia, os percentuais em massa de