Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Neutraliza-se 50 mL de solução aquosa de hidróxido de sódio 0,10 mol L-1 com 50 mL de solução aquosa de ácido clorídrico 0,10 mol L-1 . Nessa reação, há formação de água. As espécies Na+ e Cl- os são íons espectadores.
NaOH(aq) + HCl(aq) → H2O(l) + NaCl(aq)
Admitindo como desprezível a expansão de volume como resultado dessa reação, a concentração de Cl- , em quantidade de matéria (mol L-1 ), na solução resultante é aproximadamente igual a: (A)
A tabela periódica dos elementos é uma base de dados que possibilita prever o comportamento, propriedades e características dos elementos químicos.
Com as informações que podem ser obtidas da tabela periódica, relacione os elementos apresentados na coluna da esquerda com a informação da coluna à direita que indica a respectiva distribuição dos elétrons nos subníveis do último nível de energia ocupado no estado fundamental.
Elemento químico Configuração no último nível
I – Bromo X – s2
II – Estanho Y – s2 p4
III – Polônio Z – s2 p2
IV – Rádio
Estão corretas as associações:
A decomposição de uma amostra de carbonato de cálcio consumiu 266 kJ. A partir desse resultado e da equação termoquímica abaixo, conclui-se que:
CaCO3(s) → CaO(s) + CO2(g); ΔH = +133 kJ mol-1
Considere as afirmativas a seguir sobre o 2-metilpentano.
I – Possui cadeia carbônica normal.
II – Possui fórmula molecular C6 H14.
III – É um hidrocarboneto insaturado.
IV – Possui três átomos de carbono primários.
É correto o que se afirma somente em:
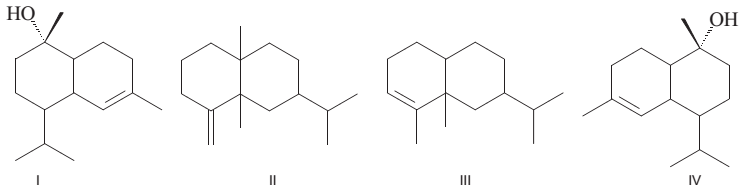
Sobre as substâncias I, II, III e IV, tem-se que:
Carbonato de cobalto é um sal muito pouco solúvel em água e, quando saturado na presença de corpo de fundo, a fase sólida se encontra em equilíbrio com os seus íons no meio aquoso.
CoCO3(s) ⇌ Co2+(aq) + CO32-(aq)
Sendo o produto de solubilidade do carbonato de cobalto, a 25 oC, igual a 1,0 x 10-10, a solubilidade do sal, em mol L-1, nessa temperatura é
A reação do iodato de potássio com bissulfito de sódio, em meio aquoso pode ser representada na sua forma iônica, sem os íons espectadores, como segue:
IO3-(aq) + HSO3-(aq) → I-(aq) + SO42-(aq) + H+(aq)
No balanço de massa e no balanço de carga com os menores coeficientes inteiros, a relação entre as quantidades, em mol, da espécie oxidante e da espécie redutora é de:
A decomposição enzimática da ureia se dá pela ação da enzima urease em grande excesso de água. (NH2)2CO + H2O
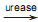 2 NH3 + CO2
2 NH3 + CO2
A lei de velocidade dessa reação é: vel = k[(NH2)2 CO] [urease]
Onde vel é a velocidade da reação, e os termos entre colchetes são as concentrações de ureia e urease num determinado instante, e k é a constante de velocidade. Sobre a reação, a única opção incorreta é:
O sulfeto de ferro pode ser usado como matéria prima para produção de ácido sulfúrico como indicado na reação.
4 FeS + 9 O2 + 4 H2O → 2 Fe2O3 + 4 H2SO4
Numa reação completa e com FeS como reagente limitante, a massa desse sulfeto metálico que mais se aproxima da necessária para produzir 10 mol de H2SO4 é:
CO2(g), dissolvido em água, H2CO3 no meio aquoso, e HCO3-, no meio aquoso, encontram-se em equilíbrio de acordo com as representações abaixo:
(I) CO2(aq) + H2O
 H2CO3 (aq)
(II) H2CO3(aq) + H2O
H2CO3 (aq)
(II) H2CO3(aq) + H2O HCO3-(aq) + H3O+(aq)
HCO3-(aq) + H3O+(aq)(III) HCO3- (aq) + H2O
 CO32-(aq) + H3O+(aq)
CO32-(aq) + H3O+(aq)Sobre esse comportamento é correto afirmar que:
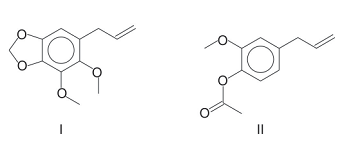
Considerando essas substâncias, pode-se afirmar que:
Aquecer uma gordura na presença de uma base consiste em um método tradicional de obtenção de sabão (sal de ácido graxo), chamado de saponificação.
Dentre as opções, a estrutura que representa um sabão é
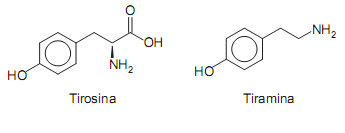
A ardência provocada pela pimenta dedoͲdeͲmoça é resultado da interação da substância capsaicina com receptores localizados na língua, desencadeando impulsos nervosos que se propagam até o cérebro, o qual interpreta esses impulsos na forma de sensação de ardência. Esse tipo de pimenta tem, entre outros efeitos, o de estimular a sudorese no organismo humano.
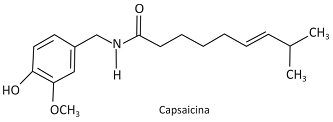
Considere as seguintes afirmações:
I. Nas sinapses, a propagação dos impulsos nervosos, desencadeados pelo consumo dessa pimenta, se dá pela ação de neurotransmissores.
II. Ao consumir essa pimenta, uma pessoa pode sentir mais calor pois, para evaporar, o suor libera calor para o corpo.
III. A hidrólise ácida da ligação amídica da capsaicina produz um aminoácido que é transportado até o cérebro, provocando a sensação de ardência.
É correto apenas o que se afirma em
Soluções aquosas de ácido clorídrico, HCl (aq), e de ácido acético, H3CCOOH (aq), ambas de concentração 0,10 mol/L, apresentam valores de pH iguais a 1,0 e 2,9, respectivamente.
Em experimentos separados, volumes iguais de cada uma dessas soluções foram titulados com uma solução aquosa de hidróxido de sódio, NaOH (aq), de concentração adequada. Nessas titulações, a solução de NaOH foi adicionada lentamente ao recipiente contendo a solução ácida, até reação completa. Sejam V1 o volume da solução de NaOH para reação completa com a solução de HCl e V2 o volume da solução de NaOH para reação completa com a solução de H3CCOOH. A relação entre V1 e V2 é
Uma estudante de Química realizou o seguinte experimento: pesou um tubo de ensaio vazio, colocou nele um pouco de NaHCO3 (s) e pesou novamente. Em seguida,adicionou ao tubo de ensaio excesso de solução aquosa de HCl, o que provocou a reação química representada por
NaHCO3(S) + HCl(aq) → NaCl(aq) + CO2(g) +H2O(l)
Após a reação ter-se completado, a estudante aqueceu o sistema cuidadosamente, até que restasse apenas um sólido seco no tubo de ensaio. Deixou o sistema resfriar até a temperatura ambiente e o pesou novamente. A estudante anotou os resultados desse experimento em seu caderno, juntamente com dados obtidos consultando um manual de Química:

A estudante desejava determinar a massa de
I. HCl que não reagiu;
II. NaCl que se formou;
III. CO2 que se formou.
Considerando as anotações feitas pela estudante, é possível
determinar a massa de