Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
I. Quando dissolvidos em água, os gases CO2, SO2, SO3 e HCl geram soluções eletrolíticas cujo pH é menor que 7.
II. As moléculas de CO2, SO2 e H2O apresentam geometria linear.
III. No estado sólido, as moléculas de CO2 encontram-se atraídas entre si por ligações de hidrogênio muito intensas.
É correto o que se afirma em:
CO2 (aq) + H2O (l)
 H+ (aq) + HCO3– (aq)
H+ (aq) + HCO3– (aq)A diminuição do pH do sangue constitui a acidose, que provoca náusea, vômito e cansaço. O aumento do pH do sangue corresponde à alcalose, que provoca distúrbios respiratórios, cãibras e convulsões. Considere as seguintes afirmações:
I. Pessoas com deficiência respiratória não exalam CO2 suficientemente, com o que a reação deste com H2O se desloca para a esquerda.
II. Pessoas ansiosas respiram rapidamente, eliminando muito CO2 , com o que a reação deste com H2O se desloca para a esquerda.
III. Pessoas com diarreia sofrem grande perda de íons bicarbonato, com o que a reação do CO2 com H2O se desloca para a direita.
É correto o que se afirma em:
(www.agencia.fapesp.br. Adaptado.)
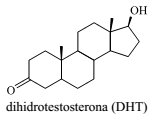
Sobre a DHT, cuja fórmula está representada, é correto afirmar que:
A bateria de níquel-cádmio (pilha seca), usada rotineiramente em dispositivos eletrônicos, apresenta a seguinte reação de oxirredução
Cd(s) + NiO2(s) + 2 H2O (l) → Cd(OH)2(s) + Ni(OH)2(s)
O agente oxidante e o agente redutor dessa reação, respectivamente, são:
Incêndio é uma ocorrência de fogo não controlado, potencialmente perigosa para os seres vivos. Para cada classe de fogo existe pelo menos um tipo de extintor. Quando o fogo é gerado por líquidos inflamáveis como álcool, querosene, combustíveis e óleos, os extintores mais indicados são aqueles com carga de pó químico ou gás carbônico.
Considerando-se a massa molar do carbono = 12 g.mol–1 , a massa molar do oxigênio = 16 g.mol–1 e R = 0,082 atm.L.mol–1 .K–1 , o volume máximo, em litros, de gás liberado a 27 ºC e 1 atm, por um extintor de gás carbônico de 8,8 kg de capacidade, é igual a:
A sibutramina, cuja estrutura está representada, é um fármaco indicado para o tratamento da obesidade e seu uso deve estar associado a uma dieta e exercícios físicos.
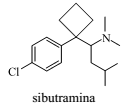
Com base nessa estrutura, pode-se afirmar que a sibutramina:
I. A combustão completa do metano (CH4 ) produzindo CO2 e H2 O.
II. O derretimento de um iceberg.
III. O impacto de um tijolo no solo ao cair de uma altura h.
Em relação aos processos analisados, pode-se afirmar que:
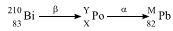
O número atômico X, o número de massa Y e o número de massa M, respectivamente, são:
Distribuição esquemática de íons
de um sal dissolvido em água
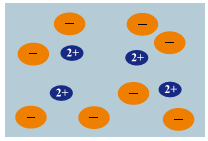
O composto que representa melhor a solução esquematizada na figura é:

• Juliana preferiu usar fermento químico em pó. Misturou o fermento ao leite fervente, esperou que esfriasse, adicionou os ovos, a manteiga, o açúcar e a farinha, e colocou o bolo para assar em forno a gás previamente aquecido.
• Guilherme fez o mesmo, porém, ao invés de usar fermento químico, preferiu usar fermento biológico.
• Mariana também usou fermento biológico, que foi misturado à farinha, ao açúcar, à manteiga, aos ovos e ao leite frio, e a massa foi imediatamente colocada em forno a gás previamente aquecido.
• Roberto agiu exatamente como Mariana, mas, ao invés de colocar o bolo no forno a gás, de imediato colocou-o em forno de micro-ondas.
• Rafael também fez o mesmo que Mariana, mas optou pelo fermento químico.
Apenas um bolo cresceu, e foi dividido por todos.
Considerando-se as reações químicas e os processos biológicos que fazem o bolo crescer, pode-se afirmar corretamente que o bolo saboreado pelos estudantes foi aquele preparado por

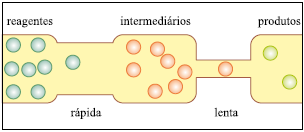 Figura
Figura Em seguida, solicitou aos estudantes que traçassem um gráfico da energia em função do caminho da reação, para o sistema representado. Para atender corretamente à solicitação do professor, os estudantes devem apresentar um gráfico como o que está representado em:
(www.inovacaotecnologica.com.br. Adaptado.)

Com base nessas informações, é correto afirmar que:
(Considere 1 mol de elétrons – 96500 C)
Em relação à eletrólise, afirma-se:
I. É uma reação espontânea de oxidorredução produzida a partir da corrente elétrica.
II. Através da eletrólise ígnea do óxido de alumínio é possível obter, além de alumínio metálico, o oxigênio gasoso.
III. A redução ocorre no polo positivo denominado cátodo.
IV. A oxidação ocorre no polo positivo denominado ânodo.
V. Se numa célula eletrolítica industrial utilizarmos uma corrente elétrica de 19300 A, e admitindo uma eficiência de 90%, será possível produzir em um dia aproximadamente 140 Kg de alumínio.
Estão corretas APENAS:
I. CH4
II. CH3Cl
III. CH3OH
IV. HCOOH
Dado esse contexto, é CORRETO afirmar:
K2Cr2O7(aq.) + H2SO4(aq.) + C2H5OH(v) → C2H4O(g) + K2SO4(aq.) + Cr2(SO4)3(aq.) + H2O(l)
Analise as afirmativas referentes a esse processo químico.
I. A equação química corretamente balanceada tem como soma dos menores números inteiros 31.
II. A equação química corretamente balanceada tem como soma dos menores coeficientes inteiros 20.
III. O etanol é oxidado a aldeído acético e o dicromato
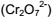 , amarelo-alaranjado, da
origem ao sulfato de íon crômio (III), verde.
, amarelo-alaranjado, da
origem ao sulfato de íon crômio (III), verde.
IV. O agente oxidante é o dicromato de potássio; portanto, ele contém o elemento que recebe elétrons, sofrendo redução.
V. O agente redutor é o ácido sulfúrico; portanto, contém o elemento que perde elétrons, sofrendo oxidação.
É correto o que se afirma APENAS em: