Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Disponível em:<http:// www1.folha.uol.com.br/cotidiano/2015/08/1671619-quase-13-das-criancas-com menos-de 2-anos-bebem-refrigerante-aponta-ibge.shtml> . Acesso em: 20 ago. 15. (Adaptado.)
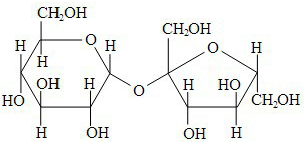
Em relação à sacarose, considere as proposições abaixo.
I É um açúcar redutor, de fórmula molecular C12H22O11, que não pode ser hidrolisado por soluções ácidas diluídas.
II É solúvel em água, devido ao rompimento da ligação entre as unidades de glicose e frutose.
III É um dissacarídeo, de caráter polar, e que apresenta na sua estrutura apenas átomos de carbono hibridizados na forma sp3 .
Das proposições acima,
Disponível em:<http://aspiraçoesquimicas.net/2014/08/feromonios-e-a-quimica-das-abelhas.html/> . Acesso em: 20 ago. 15. (Adaptado.)
Em relação às substâncias orgânicas mencionadas acima, assinale a alternativa correta.
A titulação de 50 mL de uma solução aquosa de ácido clorídrico, com uma solução aquosa de hidróxido de sódio de concentração molar igual a 0,1 mol/L, utilizando fenolftaleína como indicador, está representada no gráfico a seguir.
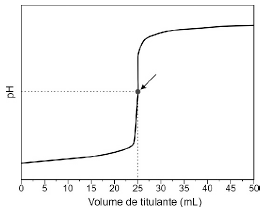
Considerando as informações do enunciado e do gráfico, assinale a alternativa correta.
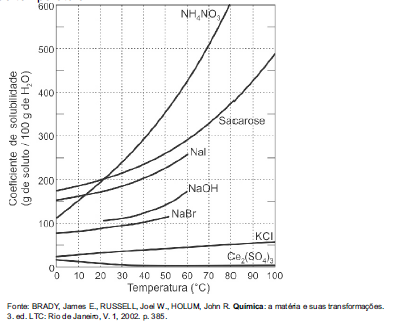
Considerando as informações apresentadas pelo gráfico acima, assinale a alternativa correta.
A equação química que descreve, simplificadamente, o processo de obtenção industrial do 1,2-dicloroetano, a partir da reação de adição de gás cloro ao eteno, encontra-se representada abaixo.
C2H4(g) + Cℓ2(g) ® C2H4Cℓ2(ℓ)
Disponível em:<http://laboratorios.cetesb.sp.gov.br/wp-content/uploads/sites/47/2013/11/dicloroetano.pdf>. Acesso em: 3 set. 15. (Adaptado.)
A variação de entalpia da reação acima é igual a
Dados:
Ligação Energia de ligação (kJ/mol)
C–H 413,4
C–Cℓ 327,2
C–C 346,8
C=C 614,2
Cℓ–Cℓ 242,6
Temperatura (°C) Pressão máxima de vapor de água
no ar atmosférico (mm Hg)
10 9,2
20 17,5
30 31,8
40 55,3
A umidade relativa (UR) é um termo utilizado com frequência pelos meteorologistas para indicar a quantidade de vapor de água presente no ar atmosférico. Em uma mesma temperatura, a UR pode ser obtida pela razão entre a pressão parcial de vapor de água presente no ar e a pressão máxima de vapor de água. Assim, um local onde a temperatura encontra-se a 20 °C e a pressão parcial de vapor de água é igual a 10,5 mm Hg, terá uma UR, em termos percentuais, de
PbCO3(s) + 2 HNO3(aq) ® Pb(NO3)2(aq) + H2O (ℓ) + CO2(g) (Equação 1)
Pb(NO3)2(aq) + H2SO4(aq) ® PbSO4(s) + 2 HNO3(aq) (Equação 2)
Supondo que uma amostra de 0,79 g do mineral tenha produzido 0,84 g de PbSO4, pode-se concluir que a porcentagem em massa de PbCO3 na amostra é, em valores arredondados, de
Disponível em:<http://info.abril.com.br/noticias/ciencia/2015/07mit-1.shtml> . Acesso em: 20 ago. 15. (Adaptado.)
Em relação ao nióbio, analise as proposições a seguir, quanto à sua veracidade (V) ou falsidade (F).
( ) O elemento químico nióbio é um metal de transição interna do quarto período da Tabela Periódica.
( ) Átomos de nióbio, no estado fundamental, apresentam 5 elétrons na camada de valência.
( ) O elétron de maior energia de um átomo de nióbio, no estado fundamental, encontra-se no subnível 4s.
( ) A liga ferro-nióbio é um exemplo de solução sólida, onde os átomos de ferro e de nióbio estão unidos entre si por meio de ligações metálicas.
Assinale a alternativa que preenche correta e respectivamente os parênteses, de cima para baixo.
TEXTO 7
Memórias de um pesquisador
Não era bem vida, era uma modorra – mas de qualquer modo suportável e até agradável. Terminou bruscamente, porém, eu estando com vinte e oito anos e um pequeno bujão de gás explodindo mesmo à minha frente, no laboratório de eletrônica em que trabalhava, como auxiliar. Me levaram às pressas para o hospital, os médicos duvidando que eu escapasse. Escapei, mas não sem danos. Perdi todos os dedos da mão esquerda e três (sobraram o polegar e o mínimo) da direita. Além disso fiquei com o rosto seriamente queimado. Eu já não era bonito antes, mas o resultado final – mesmo depois das operações plásticas – não era agradável de se olhar. Deus, não era nada agradável.
No entanto, nos primeiros meses após o acidente eu não via motivos para estar triste. Aposentei-me com um bom salário. Minha velha tia, com quem eu morava, desvelava-se em cuidados. Preparava os pastéis de que eu mais gostava, cortava-os em pedacinhos que introduzia em minha boca – derramando sentidas lágrimas cuja razão, francamente, eu não percebia. Deves chorar por meu pai – eu dizia – que está morto, por minha mãe que está morta, por meu irmão mais velho que está morto; mas choras por mim. Por quê? Escapei com vida de uma explosão que teria liquidado qualquer um; não preciso mais trabalhar; cuidas de mim com desvelo; de que devo me queixar?
Cedo descobri. Ao visitar certa modista.
Esta senhora, uma viúva recatada mas ardente, me recebia todos os sábados, dia em que os filhos estavam fora. Quando me senti suficientemente forte telefonei explicando minha prolongada ausência e marcamos um encontro.
Ao me ver ficou, como era de se esperar, consternada. Vais te acostumar, eu disse, e propus irmos para a cama. Me amava, e concordou. Logo me deparei com uma dificuldade: o coto (assim eu chamava o que tinha me sobrado da mão esquerda) e a pinça (os dois dedos restantes da direita) não me forneciam o necessário apoio. O coto, particularmente, tinha uma certa tendência a resvalar pelo corpo coberto de suor da pobre mulher. Seus olhos se arregalavam; quanto mais apavorada ficava, mais suava e mais o coto escorregava.
Sou engenhoso. Trabalhando com técnicos e cientistas aprendi muita coisa, de modo que logo resolvi o problema: com uma tesoura, fiz duas incisões no colchão. Ali ancorei coto e pinça. Pude assim amá-la, e bem.
– Não aguentava mais – confessei, depois. – Seis meses no seco!
Não me respondeu. Chorava. – Vais me perdoar, Armando – disse – eu gosto de ti, eu te amo, mas não suporto te ver assim. Peço-te, amor, que não me procures mais.
– E quem vai me atender daqui por diante? – perguntei, ultrajado.
Mas ela já estava chorando de novo. Levantei-me e saí. Não foi nessa ocasião, contudo, que fiquei deprimido. Foi mais tarde; exatamente uma semana depois.
[...]
(SCLIAR, Moacyr. Melhores contos. Seleção de
Regina Zilbermann. São Paulo: Global, 2003. p.
176-177.)
O odor desagradável exalado junto com a transpiração deve-se a compostos malcheirosos produzidos a partir do metabolismo de microrganismos que utilizam o material liberado por glândulas presentes nas axilas, por exemplo. Um exemplo de substância responsável pelo mau cheiro é o ácido 3-metil-hex-2-enoico. O triclosan, um composto utilizado em desodorantes, inibe a atuação dos microrganismos e, com isso, previne o mau cheiro. Alguns desodorantes utilizam o bicarbonato de sódio, que neutraliza os compostos responsáveis pelo odor desagradável.
Sobre as informações apresentadas são feitas as seguintes afirmações:
I - O ácido 3-metil-hex-2-enoico é um composto orgânico ternário saturado, de fórmula molecular C6 H12O2 .
II - Na composição centesimal do ácido 3-metil-hex-2-enoico, observa-se que o oxigênio é o elemento que apresenta menor porcentagem em massa.
III - O bicarbonato de sódio, representado pela fórmula NaHCO3 , reage com ácido orgânico, formando sal de caráter alcalino.
IV - Sabendo-se que no triclosan existe uma hidroxila ligada em anel aromático, pode-se dizer que isso caracteriza a presença de função fenol no referido composto.
Assinale a alternativa que apresenta apenas itens corretos:
TEXTO 7
Memórias de um pesquisador
Não era bem vida, era uma modorra – mas de qualquer modo suportável e até agradável. Terminou bruscamente, porém, eu estando com vinte e oito anos e um pequeno bujão de gás explodindo mesmo à minha frente, no laboratório de eletrônica em que trabalhava, como auxiliar. Me levaram às pressas para o hospital, os médicos duvidando que eu escapasse. Escapei, mas não sem danos. Perdi todos os dedos da mão esquerda e três (sobraram o polegar e o mínimo) da direita. Além disso fiquei com o rosto seriamente queimado. Eu já não era bonito antes, mas o resultado final – mesmo depois das operações plásticas – não era agradável de se olhar. Deus, não era nada agradável.
No entanto, nos primeiros meses após o acidente eu não via motivos para estar triste. Aposentei-me com um bom salário. Minha velha tia, com quem eu morava, desvelava-se em cuidados. Preparava os pastéis de que eu mais gostava, cortava-os em pedacinhos que introduzia em minha boca – derramando sentidas lágrimas cuja razão, francamente, eu não percebia. Deves chorar por meu pai – eu dizia – que está morto, por minha mãe que está morta, por meu irmão mais velho que está morto; mas choras por mim. Por quê? Escapei com vida de uma explosão que teria liquidado qualquer um; não preciso mais trabalhar; cuidas de mim com desvelo; de que devo me queixar?
Cedo descobri. Ao visitar certa modista.
Esta senhora, uma viúva recatada mas ardente, me recebia todos os sábados, dia em que os filhos estavam fora. Quando me senti suficientemente forte telefonei explicando minha prolongada ausência e marcamos um encontro.
Ao me ver ficou, como era de se esperar, consternada. Vais te acostumar, eu disse, e propus irmos para a cama. Me amava, e concordou. Logo me deparei com uma dificuldade: o coto (assim eu chamava o que tinha me sobrado da mão esquerda) e a pinça (os dois dedos restantes da direita) não me forneciam o necessário apoio. O coto, particularmente, tinha uma certa tendência a resvalar pelo corpo coberto de suor da pobre mulher. Seus olhos se arregalavam; quanto mais apavorada ficava, mais suava e mais o coto escorregava.
Sou engenhoso. Trabalhando com técnicos e cientistas aprendi muita coisa, de modo que logo resolvi o problema: com uma tesoura, fiz duas incisões no colchão. Ali ancorei coto e pinça. Pude assim amá-la, e bem.
– Não aguentava mais – confessei, depois. – Seis meses no seco!
Não me respondeu. Chorava. – Vais me perdoar, Armando – disse – eu gosto de ti, eu te amo, mas não suporto te ver assim. Peço-te, amor, que não me procures mais.
– E quem vai me atender daqui por diante? – perguntei, ultrajado.
Mas ela já estava chorando de novo. Levantei-me e saí. Não foi nessa ocasião, contudo, que fiquei deprimido. Foi mais tarde; exatamente uma semana depois.
[...]
(SCLIAR, Moacyr. Melhores contos. Seleção de
Regina Zilbermann. São Paulo: Global, 2003. p.
176-177.)
A pólvora, usada como explosivo desde tempos remotos, é uma mistura de nitrato de potássio, enxofre e carvão. Com a explosão, ocorre formação de sulfato de potássio, dióxido de carbono e nitrogênio molecular.
Sobre essa explicação acerca da explosão, assinale a única afirmação correta:
TEXTO 5
NA VIRADA DO SÉCULO, o biólogo Roosmarc conheceu o ápice da fama ao descobrir um novo gênero de primata: o sagui-anão-de-coroa-preta. Foi considerado pela revista Time o grande herói do planeta. Entre os mais de 500 primatas no mundo, Roosmarc descobrira o Callibella humilis, o macaquinho mais saltitante e alegre, anãozinho, com aquela coroa preta. Enquanto outros primatólogos matavam os animais para descrevê-los, dissecando-os em laboratórios, longe da Amazônia, ele criava macacos em sua casa. Esperava que morressem de forma natural e, aí sim, dissecava-os.
O sagui-anão-de-coroa-preta foi a sensação mundial. Então, ele viveu o ápice da glória. As publicações científicas não se cansaram de elogiá-lo. Quase todos os dias, jornais e revistas estampavam: “Protetor dos animais”, “O bandeirantes da Amazônia”, “O último primatólogo”. De Manaus para o mundo. Os ribeirinhos o saudavam; os políticos o pajeavam; os estudantes de biologia o veneravam. Sim, Roosmarc era visto e considerado como herói do planeta.
Vida simples, com suas vestes quase sempre largas cobrindo o corpo magro e alto, enfiado semanas na floresta, nunca quisera dinheiro, jamais almejara fortuna. O verdadeiro cientista, dizia, quer, antes de tudo, reconhecimento. Não havia prêmio maior do que isso. Sequer gastava o que ganhava. Aprendera com os bichos que, na vida, não se precisa de muitas coisas...
Nascera no sul da Holanda e, aos 17 anos, mudou-se para Amsterdã. Queria estudar biologia. Nos fins do ano 60, a cidade fervilhava, era a capital da contestação. John Lennon e Yoko Ono haviam escolhido a cidade para protestar contra a Guerra do Vietnã. Os rebeldes desfilavam pelas ruas, enquanto John Lennon e Yoko Ono incitavam a quebra de valores deitados uma semana num hotel da cidade, consumindo droga e criando suas canções. O gosto pela contracultura crescia, agigantava-se. Rebelde, Roosmarc desfilava pelas ruas, gritando pela paz, também queimando maconha e outras ervas.
Mas foi, nesta época, que ele se interessou pelos primatas. Depois que terminou a universidade, fez amizade com uma estudante, que também saboreava a contracultura, o desprezo a normas e procedimentos, e com ela, vivendo um romance apaixonado, deu volta ao mundo, como se fosse o famigerado navegante português Vasco da Gama. Estudante de artes plásticas, Marie tinha sede por aventuras: o novo lhe apetecia; o velho não era mais do que um mundo cinzento. A Europa, com seus prédios cinzentos e frios, uma população resignada, não lhe apetecia. Queria quebrar barreiras, outras fronteiras. Não queria apodrecer naquelas cidadezinhas holandesas, onde as mulheres envelheciam rapidamente e só cuidavam de casa. Não queria se transformar num símbolo de cama, fogão e igreja. Menosprezava o título “rainha do lar”, que os pastores tanto veneravam entre a população fiel. Tinha horror ao ver sua mãe de lenço na cabeça e avental cobrindo a gordura da barriga. Se ficasse numa daquelas cidadezinhas, em poucos anos estaria como a mãe – brigava constantemente com o seu pai, saía de casa aos domingos para assistir a mesmice do partor Simeão, e que, rapidamente, voltava para casa para preparar o almoço para os filhos. Que destino! A liberdade a chamava. Não era o que dizia a canção de John Lennon? Ao conhecer Roosmarc, o desejo por aventuras avivou como brasa viva. Quando convidada para segui-lo, e ela queria produzir desenhos e aquarelas jamais vistas no mundo, não titubeou, como se a oportunidade fosse um cavalo encilhado. E cavalo encilhado passa por nós somente uma vez ...
(GONÇALVES, David. Sangue verde. Joinville: Sucesso Pocket, 2014. p. 200-201.Adaptado.)
Analise as afirmativas a seguir:
I- Se dentro do botijão for armazenado um gás perfeito, o volume ocupado pelas suas moléculas e as interações entre elas serão desprezíveis.
II-Pela lei da conservação das massas, a queima de 13 kg de gás de cozinha irá produzir 13 kg de produtos da reação.
III-Em um botijão contendo 31,5 L de um gás perfeito, submetido à pressão de 1 atm e temperatura de 0ºC, haverá aproximadamente 8,5 x 1023 moléculas do referido gás. Dados: número de Avogadro 6,022 x 1023; volume molar 22,4 L/mol.
IV- Supondo-se que um botijão de gás cheio, com 13 kg de uma mistura em estado gasoso composta por 55% de butano e 45% de propano, a pressão parcial desses gases é, respectivamente, de 97 atm e 104 atm. Dados: R = 0,082 atm.L/mol.K; T = 273,15K; V = 31,5 L.
Em relação às proposições analisadas, assinale a única alternativa cujos itens estão todos corretos:
TEXTO 5
NA VIRADA DO SÉCULO, o biólogo Roosmarc conheceu o ápice da fama ao descobrir um novo gênero de primata: o sagui-anão-de-coroa-preta. Foi considerado pela revista Time o grande herói do planeta. Entre os mais de 500 primatas no mundo, Roosmarc descobrira o Callibella humilis, o macaquinho mais saltitante e alegre, anãozinho, com aquela coroa preta. Enquanto outros primatólogos matavam os animais para descrevê-los, dissecando-os em laboratórios, longe da Amazônia, ele criava macacos em sua casa. Esperava que morressem de forma natural e, aí sim, dissecava-os.
O sagui-anão-de-coroa-preta foi a sensação mundial. Então, ele viveu o ápice da glória. As publicações científicas não se cansaram de elogiá-lo. Quase todos os dias, jornais e revistas estampavam: “Protetor dos animais”, “O bandeirantes da Amazônia”, “O último primatólogo”. De Manaus para o mundo. Os ribeirinhos o saudavam; os políticos o pajeavam; os estudantes de biologia o veneravam. Sim, Roosmarc era visto e considerado como herói do planeta.
Vida simples, com suas vestes quase sempre largas cobrindo o corpo magro e alto, enfiado semanas na floresta, nunca quisera dinheiro, jamais almejara fortuna. O verdadeiro cientista, dizia, quer, antes de tudo, reconhecimento. Não havia prêmio maior do que isso. Sequer gastava o que ganhava. Aprendera com os bichos que, na vida, não se precisa de muitas coisas...
Nascera no sul da Holanda e, aos 17 anos, mudou-se para Amsterdã. Queria estudar biologia. Nos fins do ano 60, a cidade fervilhava, era a capital da contestação. John Lennon e Yoko Ono haviam escolhido a cidade para protestar contra a Guerra do Vietnã. Os rebeldes desfilavam pelas ruas, enquanto John Lennon e Yoko Ono incitavam a quebra de valores deitados uma semana num hotel da cidade, consumindo droga e criando suas canções. O gosto pela contracultura crescia, agigantava-se. Rebelde, Roosmarc desfilava pelas ruas, gritando pela paz, também queimando maconha e outras ervas.
Mas foi, nesta época, que ele se interessou pelos primatas. Depois que terminou a universidade, fez amizade com uma estudante, que também saboreava a contracultura, o desprezo a normas e procedimentos, e com ela, vivendo um romance apaixonado, deu volta ao mundo, como se fosse o famigerado navegante português Vasco da Gama. Estudante de artes plásticas, Marie tinha sede por aventuras: o novo lhe apetecia; o velho não era mais do que um mundo cinzento. A Europa, com seus prédios cinzentos e frios, uma população resignada, não lhe apetecia. Queria quebrar barreiras, outras fronteiras. Não queria apodrecer naquelas cidadezinhas holandesas, onde as mulheres envelheciam rapidamente e só cuidavam de casa. Não queria se transformar num símbolo de cama, fogão e igreja. Menosprezava o título “rainha do lar”, que os pastores tanto veneravam entre a população fiel. Tinha horror ao ver sua mãe de lenço na cabeça e avental cobrindo a gordura da barriga. Se ficasse numa daquelas cidadezinhas, em poucos anos estaria como a mãe – brigava constantemente com o seu pai, saía de casa aos domingos para assistir a mesmice do partor Simeão, e que, rapidamente, voltava para casa para preparar o almoço para os filhos. Que destino! A liberdade a chamava. Não era o que dizia a canção de John Lennon? Ao conhecer Roosmarc, o desejo por aventuras avivou como brasa viva. Quando convidada para segui-lo, e ela queria produzir desenhos e aquarelas jamais vistas no mundo, não titubeou, como se a oportunidade fosse um cavalo encilhado. E cavalo encilhado passa por nós somente uma vez ...
(GONÇALVES, David. Sangue verde. Joinville: Sucesso Pocket, 2014. p. 200-201.Adaptado.)
Beck, fino, banza, cano do diabo ou simplesmente baseado são exemplos de gírias usadas para designar um cigarro de maconha. Preparado de forma manual, um desses cigarros pode conter até um grama de maconha, quantidade suficiente para fazer muita fumaça. A maconha é produzida a partir da folha da Cannabis sativa. Como toda planta, ela é constituída de várias substâncias. Dentre elas, temos o canabidiol (C21H30O2 , de massa molar = 314,45g/mol), que pode chegar a quase 40% do extrato vegetal. O canabidiol apresenta baixa toxicidade em seres humanos e em outras espécies: a LD50 (quantidade de ingrediente ativo de uma substância tóxica necessária para matar 50% de animais testados) após a administração intravenosa em macacos foi de 212 mg/kg (SCUDERI et al., 2008).
(SCUDERI, Caterina et al. Cannabidiol in Medicine: a review of its therapeutic potential in CNS
Disorders. Phytotherapy research, n.23, p. 597-602. 9 Oct. 2008.)
Assinale a única alternativa correta com relação ao exposto anteriormente:
TEXTO 2
XX
Os Homens
nesta manhã de sangrenta primavera
parecem não mais saber
o que nunca souberam,
que a Vida é para sempre
sã ou demente
tão de repente
tão de repente!
(VIEIRA, Delermando. Os tambores da tempestade. Goiânia: Poligráfica, 2010. p. 108.)
Hb + O2
 HbO2
HbO2Com base nessas informações, analise as afirmativas a seguir:
I- O sangue, por ser uma solução tampão, não sofrerá alteração de pH, mesmo com a adição de grande quantidade de ácidos ou de bases.
II- O sangue tem pH em torno de 7, e o suco gástrico,em torno de 2. Isso significa uma diferença de concentração de íons hidrônio na ordem de 105.
III- Ao se subir a montanha Everest, a mudança na pressão atmosférica resulta no deslocamento da reação da hemoglobina com o oxigênio para a esquerda.
IV-O CO2 proveniente da respiração celular pode reagir com a água antes de ser transportado pela hemoglobina e ser transformado em íons hidrônio e carbonato (CO32–). A geometria molecular desse ânion é piramidal.
Em relação às proposições analisadas, assinale a única alternativa cujos itens estão todos corretos:
TEXTO 1
O mundo do menino impossível
Fim de tarde, boquinha da noite
com as primeiras estrelas e os derradeiros sinos.
Entre as estrelas e lá detrás da igreja,
surge a lua cheia
para chorar com os poetas.
E vão dormir as duas coisas novas desse mundo:
o sol e os meninos.
Mas ainda vela
o menino impossível,
aí do lado,
enquanto todas as crianças mansas
dormem
acalentadas
por Mãe-negra da Noite.
O menino impossível
que destruiu
os brinquedos perfeitos
que os vovós lhe deram:
o urso de Nurnberg,
o velho barbado jugoslavo,
as poupées de Paris aux
cheveux crêpés,
o carrinho português
feito de folha de flandres a
caixa de música checoslovaca,
o polichinelo italiano
made in England,
o trem de ferro de U. S. A.
e o macaco brasileiro
de Buenos Aires,
moviendo la cola y la cabeza.
O menino impossível
que destruiu até
os soldados de chumbo de Moscou
e furou os olhos de um Papá Noel,
brinca com sabugos de milho,
caixas vazias,
tacos de pau,
pedrinhas brancas do rio...
“Faz de conta que os sabugos
são bois...”
“Faz de conta...”
“Faz de conta...”
[...]
O menino pousa a testa
e sonha dentro da noite quieta
da lâmpada apagada,
com o mundo maravilhoso
que ele tirou do nada...
[...]
(LIMA, Jorge de. Melhores poemas. São Paulo: Global,
2006. p. 27-30. Adaptado.)
Ao morrer, esses seres param de “reciclar" o carbono e a quantidade de carbono 14 em relação ao 12 começa a decair. Quando essa relação for de 50% da original, chama-se meia-vida do carbono 14. No caso do chumbo, esse tempo de meia-vida é de 22 anos. A quantidade de carbono 14 existente em um determinado instante t é dada pela função exponencial Q(t)=Q(0) exp(-kt), em que Q(0) é a quantidade de carbono 14 no instante 0, e k é a constante, que depende do tipo de elemento radioativo. No caso do chumbo, o valor de k é (marque a alternativa correta):
Para diferenciar os hidrocarbonetos etano e eteno em uma mistura gasosa, utiliza-se uma reação com bromo molecular: o etano não reage com esse composto, enquanto o eteno reage de acordo com a seguinte equação química:
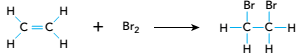
Considere um cilindro de capacidade igual a 10 L, contendo apenas esses hidrocarbonetos em uma mistura com massa igual a 200 g. Ao se adicionar bromo em excesso à mistura, todo o eteno reagiu, formando 940 g de 1,2-dibromoetano.
A concentração inicial de etano, em mol.L–1, no interior do cilindro, corresponde a:
Para descrever o comportamento dos gases ideais em função do volume V, da pressão P e da temperatura T, podem ser utilizadas as seguintes equações:
Equação de Clapeyron Equação de Boltzmann
P × V = n × R × T P × V = N × k × T
n – número de mols N – número de moléculas
R – constante dos gases k – constante de Boltzmann
De acordo com essas equações, a razão R/k é aproximadamente igual a:
A ionização do ácido cianídrico é representada pela equação química abaixo:
HCN (aq)  H+ (aq) + CN–
(aq)
H+ (aq) + CN–
(aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo
grau de ionização α
constante de equilíbrio Ka
potencial hidrogeniônico pH
concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte
símbolo:
O íon oxalacetato participa não só do ciclo de Krebs como também da produção do íon aspartato, segundo a equação abaixo:
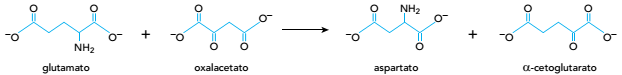
Com base nessa reação, pode-se afirmar que o aspartato é o ânion correspondente ao ácido
dicarboxílico denominado:


Considere as seguintes afirmações:
I. A aparência macroscópica do fleróvio é desconhecida, mas, provavelmente, será a de um sólido metálico.
II. Na formação do fleróvio-288, por processo análogo ao da síntese do fleróvio-289, são liberados 3 prótons.
III. No grupo da tabela periódica ao qual pertence o fleróvio, há elementos que formam óxidos covalentes.
É correto o que se afirma apenas em