Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Peter Sorensen, bioquímico dinamarquês, apesar de importantes trabalhos com proteínas, enzimas e aminoácidos, ficou mais conhecido como o criador da escala de pH, usada para medir a acidez de uma solução, que varia de zero a 14. Para preparar uma solução com pH =12 foi adicionado hidróxido de - sódio em 50 mL de água a 25 °C. A quantidade em gramas de soda cáustica necessária é de:
Dados: Na=23u, O=16u, H=1u.
A velocidade de uma reação química depende de alguns fatores, dentre eles a concentração dos reagentes que interfere na rapidez de uma reação,porém a variação da concentração dos reagentes não é igual em todas as reações . A seguir propõe-se o seguinte mecanismo em duas etapas:
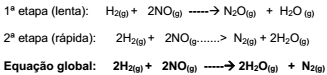
Mantendo a temperatura constante, ao duplicar a
concentração do H2(g) e reduzir à metade a
concentração do NO(g), a velocidade da reação, em
relação à velocidade inicial, torna-se:
NH3 (g) + H2O ( l) ⇌ NH4 + (aq) + OH− (aq)
A liberação de gás amônia ocorrerá com maior intensidade quando a essa solução for adicionado
I. NH4Cl (aq).
II. FeCl3 (aq).
III. NaOH (aq).
Está correto o que consta APENAS em
Quando um frasco cheio até a borda com um líquido é aquecido, em geral o líquido transborda devido à expansão de volume chamada de dilatação térmica.
Um cientista aquece o conjunto formado por um frasco de vidro cheio até a borda com um líquido, e observa que o nível do líquido abaixou.
Considerando que o frasco não possui nenhum furo ou rachadura e que a evaporação do líquido é desprezível, pode-se afirmar que
Um dos álcoois mais comuns, o etanol, queima completamente segundo a reação
C2H6O (l) + 3O2 (g) → 2CO2 (g) + 3H2O (g)
Considerando que todos os produtos dessa reação são gasosos, o volume de gás total, em m3 , produzido quando é queimado 1,0 kg de etanol, nas CNTP, é de, aproximadamente,
Dados:
Massas molares (g.mol−1 )
H = 1,0
C = 12,0
O = 16,0
Volume molar, nas CNTP = 22,4 L.mol−1
A bomba atômica, também chamada de bomba nuclear,
tem como constituinte físsil átomos de urânio-235, 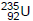 ,
emissores de partículas alfa
,
emissores de partículas alfa 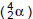 . Cada átomo de U-235,
ao emitir uma partícula alfa, transforma-se em outro
elemento, cujo número atômico é igual a
. Cada átomo de U-235,
ao emitir uma partícula alfa, transforma-se em outro
elemento, cujo número atômico é igual a
O mineral calcita, CaCO3, é um dos principais constituintes do mármore. Esse mineral pode ser dissolvido com ácidos, porque ocorre a seguinte reação:
CaCO3 (s) + 2H+ (aq) → Ca2+ (aq) + CO2 (g) + H2O (l)
Considerando uma solução de ácido clorídrico cujo pH = 0, o volume dessa solução, em mL, necessário para dissolver 1,0 g de CaCO3 é deMassa molar do CaCO3 = 100 g.mol−1
A decomposição térmica do carbonato de cálcio tem como produtos o óxido de cálcio e o dióxido de carbono. Na tabela a seguir, estão relacionados os períodos de quatro elementos químicos do grupo 2 da tabela de classificação periódica e a entalpia-padrão de decomposição do carbonato correspondente a cada um desses elementos.
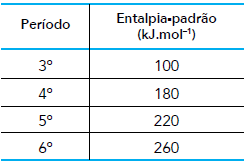
A energia, em quilojoules, necessária para a obtenção de 280 g de óxido de cálcio a partir de
seu respectivo carbonato é igual a:
Considere um corpo sólido de volume V. Ao flutuar em água, o volume de sua parte submersa é igual a V/8 ; quando colocado em óleo, esse volume passa a valer V/6.
Com base nessas informações, conclui-se que a razão entre a densidade do óleo e a da água corresponde a:
Na pele dos hipopótamos, encontra-se um tipo de protetor solar natural que contém os ácidos hipossudórico e nor-hipossudórico. O ácido hipossudórico possui ação protetora mais eficaz, devido à maior quantidade de um determinado grupamento presente em sua molécula, quando comparado com o ácido nor-hipossudórico, como se observa nas representações estruturais a seguir.
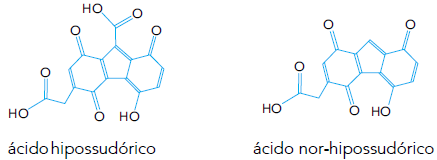
O grupamento responsável pelo efeito protetor mais eficaz é denominado:
Para fabricar um dispositivo condutor de eletricidade, uma empresa dispõe dos materiais apresentados na tabela abaixo:
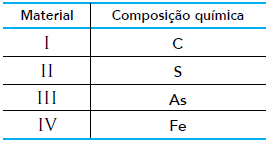
Sabe-se que a condutividade elétrica de um sólido depende do tipo de ligação interatômica existente em sua estrutura. Nos átomos que realizam ligação metálica, os elétrons livres são os responsáveis por essa propriedade.
Assim, o material mais eficiente para a fabricação do dispositivo é representado pelo seguinte
número:
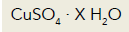
Uma amostra de 4,99 g desse sal hidratado foi aquecida até que toda a água nela contida evaporou, obtendo-se uma massa de 3,19 g de sulfato de cobre II. O número de mols de água por mol de sulfato de cobre II na composição do sal hidratado equivale a:
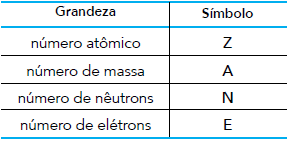
O oxigênio é encontrado na natureza sob a forma de três átomos: 16O, 17O e 18O. No estado fundamental, esses átomos possuem entre si quantidades iguais de duas das grandezas apresentadas.
Os símbolos dessas duas grandezas são:
Já naquela época, com base nesse experimento, sugeriu-se que as forças responsáveis pelas ligações químicas apresentam a seguinte natureza:
Utilize as informações a seguir para responder à questão.

A massa de cloreto de sódio a ser adicionada, em quilogramas, é igual a: