Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
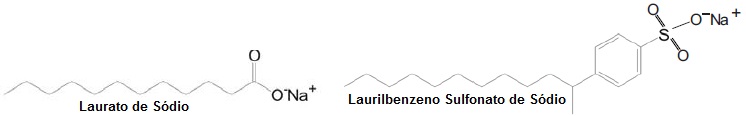
Com base nas estruturas observadas, pode-se afirmar que
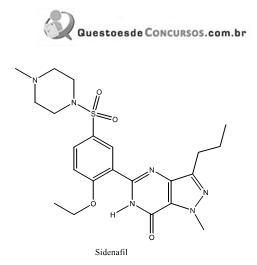
Com base nas informações mencionadas, pode-se verificar que, na estrutura do Sidenafil:

As estruturas desses monômeros e a reação de polimerização são:
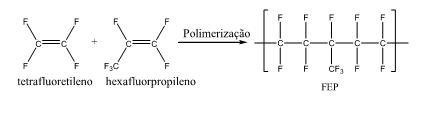
Com base nessas informações, pode-se dizer que:
I nas duas unidades monoméricas apresentadas só existem átomos de Carbono hibridizados na forma sp2 ;
II o tetrafluoetileno é mais apolar do que o hexafluorpropileno;
III em uma das unidades monoméricas apresentadas existe um átomo de Carbono tetraédrico;
IV uma das unidades monoméricas apresentadas é opticamente ativa;
V na reação de polimerização apresentada, o polímero formado possuiria maior ponto de ebulição do que as unidades monoméricas.
Assinale a opção correta.
Com base nas leis ponderais, pode-se afirmar que, segundo:
I a Lei da Conservação da Massa (Lavoisier), 1,0 g de Ferro ao ser oxidado pelo Oxigênio, produz 1,0 g de Óxido Férrico;
II a Lei da Conservação da Massa, ao se usar 16,0 g de Oxigênio molecular para reagir completamente com 40,0 g de Cálcio, são produzidas 56 g de Óxido de Cálcio;
III a Lei das Proporções Definidas, se 1,0 g de Ferro reage com 0,29 g de Oxigênio para formar o composto Óxido Ferroso, 2,0 g de Ferro reagirão com 0,87 g de Oxigênio, produzindo o mesmo composto;
IV a Lei das Proporções Múltiplas, dois mols de Ferro reagem com dois mols de Oxigênio para formar Óxido Ferroso; logo, dois mols de Ferro reagirão com três mols de Oxigênio para formar Óxido Férrico.
Assinale a opção correta.
Considere a reação simplificada da síntese do Ácido Acetilsalicílico:
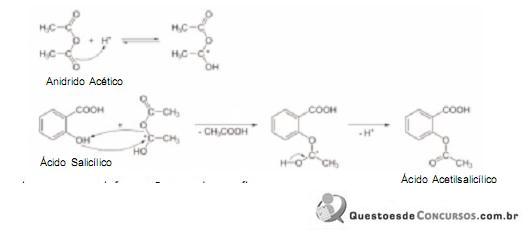
Com base nessas informações, pode-se afirmar que:
I o pH de uma solução 0,0010 M de Ácido Acetilsalicílico é igual a 11,00;
II na reação mostrada, o pH da solução está abaixo de 7,00;
III uma hidrólise no grupo funcional éster do Ácido Acetilsalicilíco com excesso de
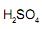 origina uma solução de pH acima de 7,00;
origina uma solução de pH acima de 7,00; IV um isômero do Ácido Salicílico é o Ácido Meta-Hidroxibenzóico;
V na fórmula estrutural do Ácido Acetilsalicílico todos os átomos de Carbono são trigonais planares.
Assinale a opção correta.

Com base nessas informações, pode-se afirmar que:
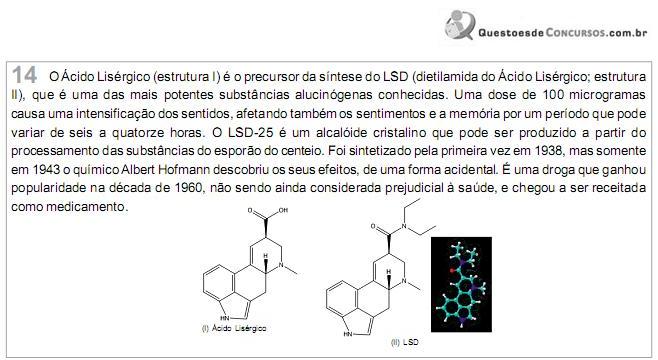
Assinale as funções orgânicas presentes nas estruturas (I) e (II), respectivamente.
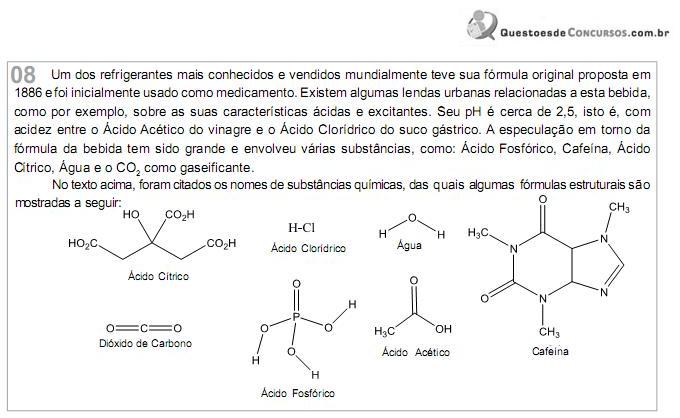
Com relação às substâncias químicas mencionadas no quadro da própria questão, assinale a opção correta.

Assinale a opção correta.
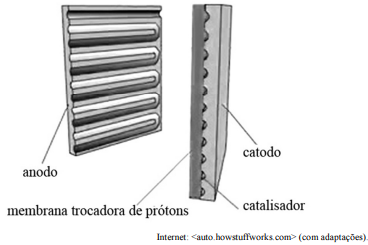
Tendo o texto precedente como referência inicial, julgue o item.
O hidrogênio é o elemento mais comum no universo; no entanto, sob a forma de substância simples (H2), ele é muito raro na Terra. Para ser usado em células a combustível, o hidrogênio puro deve ser obtido a partir de compostos de hidrogênio, incluindo-se os hidrocarbonetos fósseis. Por isso, críticos dessa tecnologia argumentam que o hidrogênio não pode ser caracterizado como um combustível “verde”, pois essa fonte energética consome hidrocarbonetos fósseis, assim como os combustíveis convencionais. Com base nesse contexto, redija um texto dissertativo, com argumento próprio, concordando ou discordando do utilizado pelos críticos da tecnologia das células a combustível.
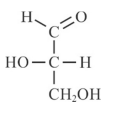
O Al2O3 é um óxido básico, de caráter iônico, formado pelos íons Al3+ e O2- .
Considere-se que o SO2 atmosférico sofra hidrólise nas gotículas de água da atmosfera em uma série de reações reversíveis, conforme descrito a seguir.
SO2 (g) + H2O (l) ⇌ H2SO3 (aq)
H2SO3 (aq) ⇌ H+ (aq) + HSO3 − (aq)
HSO3 − (aq) ⇌ H+ (aq) + SO3 2− (aq)
Nessa situação, caso a concentração atmosférica de SO2 aumente, a concentração de íons SO3 2− dissolvidos na água da chuva aumentará.
Considere: v = volume de gás hidrogênio produzido. t = tempo decorrido.
Com base na equação química:
PbSO4 + N α2CO3 → P bCO3 + N α2SO4
Considerando uma massa de pasta residual de uma bateria de 6 kg, qual quantidade aproximada, em quilogramas, de PbCO3 é obtida?
(Use massas molares em g/mol: Pb = 207; S = 32; N α = 23; O = 16; C = 12).
I. Os elementos da série de metais de transição estão situados no bloco d, entre os grupos 2 e 13 da tabela periódica. II. Nessa série, elétrons adicionais são colocados nos orbitais 3d, de acordo com a regra de Hund. III. O germânio, rigorosamente, por conta de sua distribuição eletrônica, é também considerado um metal de transição. IV. A distribuição eletrônica do metal em transição níquel é [Ar] 3d8 4s2.
Estão corretas
A conversão de sacarose em glicose ocorre por meio da reação a seguir, que tem frutose como outro produto.
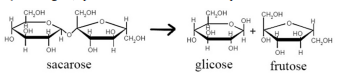
Tendo como referência a reação precedente, julgue o item a seguir.
Todas as moléculas participantes da reação em tela são
representadas pela fórmula geral (CH2O)n, em que n é um
número inteiro.
Com relação ao etanol, um dos principais produtos obtidos a partir da cana-de-açúcar, julgue o item que se segue.
As enzimas necessárias para as reações do ciclo de Krebs são
produzidas a partir do DNA mitocondrial e do DNA nuclear.
