Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Prefeitura de São Paulo pode fechar Shopping
SÃO PAULO - O prefeito de São Paulo, Gilberto Kassab, disse nesta segunda-feira que não descarta a possibilidade de interditar o Shopping Center Norte por causa da alta concentração de gás metano no local. “A constatação [é] de que essa área, no passado, foi um lixão. Esse [antigo] lixão está emitindo gases. Caso seja confirmado, vamos ter que tomar medidas, que poderão ser [desde] a exigência por parte dos empreendedores de investimento na área para captação deste gás ou, até mesmo, medidas mais drásticas, como o fechamento temporário de parte ou todo do empreendimento”, disse o prefeito.
Fonte: http://www.valor.com.br
Qual alternativa completa corretamente as lacunas na afirmação abaixo?
O metano foi formado a partir da ___________da matéria orgânica, e a provável razão da interdição do shopping
foi que o CH4 é_______________.
Queixas chegaram à Vigilância Sanitária Estadual e foram relatadas por moradores de Canoas, São Leopoldo e Porto Alegre
Na zona sul da Capital, uma menina de 10 anos foi levada ao Hospital de Pronto Socorro (HPS) depois que sentiu uma forte ardência na boca e na garganta ao beber o produto, comprado pela avó dela, que é dona de um minimercado no bairro Guarujá. A garota foi medicada e retornou para casa nesta tarde. Segundo a responsável pelo setor de alimentos da Divisão de Vigilância Sanitária do Estado, Susete Lobo Saar de Almeida, uma análise laboratorial prévia do produto constatou alterações no pH da bebida. Esse índice, que aponta o quanto uma substância é ácida ou alcalina, estaria em torno de 13 — em uma escala que vai de zero a 14 — indicando grande alcalinidade no produto.
Fonte: http://zerohora.clicrbs.com.br
Qual das substâncias abaixo poderia ter causado o problema citado na reportagem?
Fonte: http://g1.globo.com
O esquema abaixo mostra a produção de álcool etílico a partir da cana de açúcar.
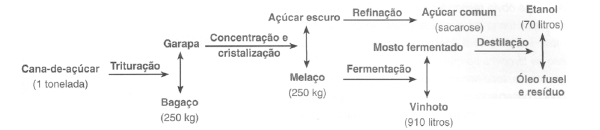
A partir dos dados informados, é possível concluir que, no período de 2011/2012, a quantidade de cana de açúcar usada para produzir o etanol será a seguinte:
I – Uma substância pura
II – Um elemento químico
III – Uma mistura de substâncias simples
IV – Uma mistura de substâncias compostas
V – Uma mistura de substâncias simples e compostas
MnO4- + Fe2+ + H+ → Mn2+ + Fe3+ + H2O
A soma dos coeficientes apenas no lado dos produtos, após o balanceamento, é
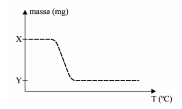
Se a diferença entre as massas X e Y no gráfico for 576 mg, o valor de Y e a porcentagem de perda da massa da reação de decomposição térmica do oxalato de magnésio são, respectivamente,
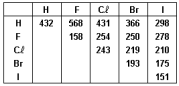
Analise as afirmações seguintes.
I. Dentre os compostos HX, o HF é o ácido mais fraco e a sua ligação H-X é a mais forte. II. A distância de ligação entre os átomos nas moléculas X2 é maior no I2, já que a sua energia de ligação é a mais fraca. III. A molécula com maior momento dipolar é o HI.
Está correto o contido em
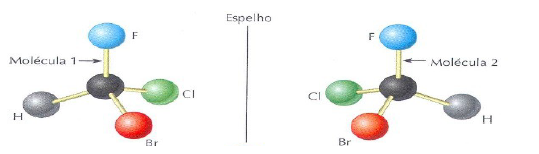
A molécula 1 tem a mesma fórmula molecular da molécula 2. Ou seja, as duas substâncias são isômeras. A molécula 1 é a imagem de espelho da molécula 2 (e vice versa). Esse tipo de isomeria denomina-se

Bicarbonato de sódio é uma substância de múltiplas
utilidades, entre elas: é um antiácido; é usado por dentistas para limpeza dos dentes e por cozinheiros para acelerar a cocção de vários alimentos.
Sua fórmula é NaHCO3
Um estudante, que gosta de fazer graça com os outros,foi a uma farmácia e pediu 1 mol de bicarbonato de sódio.
O farmacêutico, que sabia bastante química (obviamente), informou ao estudante que tinha uma embalagem de 80 gramas e que esta quantidade teria,aproximadamente, 1 mol de bicarbonato de sódio.
Na verdade, podemos afirmar que
Ao se misturar 100 mL de HCl 1/mol/L com100 mL de NaOH de mesma concentração,obtém-se uma solução de NaCl (sal de cozinha) e observa-se claramente um aumento de temperatura.
Diante do exposto, pode-se afirmar que se trata de uma reação
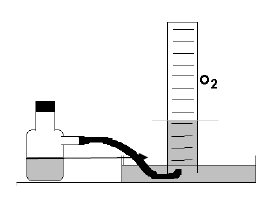
Água oxigenada contém peróxido de hidrogênio (H2O2), que, com o uso de um catalisador, se decompõe, produzindo gás oxigênio e água, conforme a equação abaixo.
H2O2 H2O + ½ O2
Um grupo de estudantes fizeram essa experiência, usando 100 mL de água oxigenada, coletando o gás oxigênio obtido sobre água, conforme ilustrado pela figura, obtendo 1,17 L de gás oxigênio, medidos a uma pressão atmosférica de 0,91atmosferas e a uma temperatura de 20 oC .
Usando a equação PV=nRT, conseguiram determinar o número de mols de O2 obtido e, consequentemente, o número de mols de H2O2 contidos no volume de água oxigenada utilizada. Dessa forma, puderam também determinar a massa deH2O2 contidos nessa água oxigenada. Diante do exposto, pode se concluir que a percentagem m/v (massa volume) deH2O2 na água oxigenada é:
Dados: Constante dos gases ideais R=0,082 atm.L/mol.KK = 273 + t (oC)
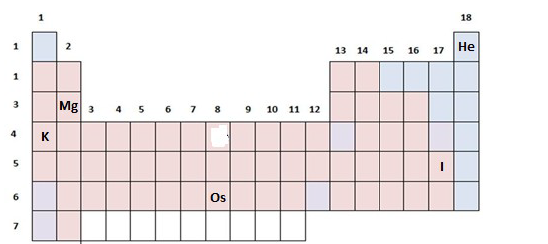
Os cinco símbolos de elementos presentes na tabela periódica acima, com todos os outros omitidos, são, respectivamente, da esquerda para a direita,
De acordo com o texto, a seqüência de fórmulas moleculares dos ácidos destacados, considerando a ordem de leitura, é:
N2(g) + 3 H2(g) ⇌ 2 NH3(g); ∆H < 0
Contudo, considerando em um determinado instante que o sistema esteja em equilíbrio, a produção de amoníaco será aumentada se:
A tabela a seguir, mostra as propriedades de cinco amostras enumeradas de I a V.
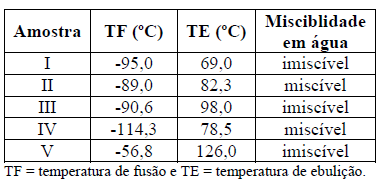
Considerando as substâncias: etanol, 2-propanol, n-hexano, n-heptano e n-octano, a opção que apresenta a identificação correta das amostras, na ordem de I a V, é:
2 NaOH(aq) + Cl2(g) → NaClO(aq) + NaCl(aq) + H2O(l)
Sobre o hipoclorito de sódio e a reação apresentada, é incorreto afirmar que:

