Questões de Vestibular Sobre química
Foram encontradas 6.520 questões
A reação de Scheele de obtenção do gás cloro

Na charge são lidas algumas substâncias que aparecem no "leite de caixinha", substâncias essas adicionadas com funções distintas na preservação e na conservação do produto.
As substâncias citadas na charge
Considere a figura abaixo.
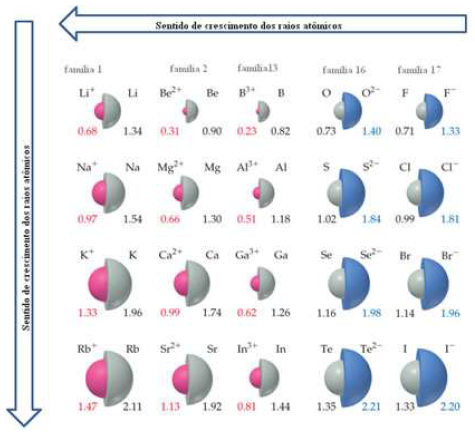
Disponível em: <http://mundoeducacao.bol.uol.com.br/upload/conteudo/crescimento-dos-raiosatomicos-na-tabela.jpg>. Acesso em 11 de março 2018.
Essa figura representa os raios atômicos e iônicos de algumas espécies químicas.
Sobre essas espécies e seus raios, é correto concluir que
Esse efeito, conhecido como
I. Com a elevação da temperatura a velocidade de uma reação química aumenta. II. O aumento da concentração dos reagentes diminui a velocidade de uma reação química. III.O uso de catalisadores aumenta a velocidade das reações químicas. IV.Quanto maior for a superfície de contato, para os sólidos, menor será a velocidade da reação química. V. A velocidade de uma reação química não depende do aumento da temperatura, do uso de catalisadores ou do aumento da superfície de contato (no caso de sólidos), apenas depende da natureza dos reagentes envolvidos.
Estão CORRETAS, apenas, as proposições
Leia o TEXTO 13 para responder à questão.
TEXTO 13
Medicamentos, exames e procedimentos sofisticados são a base da medicina curativa. Mas existe um elemento tão importante quanto esses no processo de melhoria do paciente: simplesmente saber que está sendo cuidado. Diversas pesquisas conseguiram comprovar o chamado efeito placebo, que consiste na sensação de alívio dos sintomas de determinada doença, mesmo que a pessoa não tome remédios verdadeiros. Ainda que, do ponto de vista fisiológico, o organismo não seja beneficiado com o tratamento, as “pílulas de farinha” são capazes de agir sobre o bem-estar do paciente com tanta eficácia quanto as drogas farmacêuticas.
Disponível em: /Acesso em:< https://www.correiobraziliense.com.br. Acesso em: 15 maio 2018.
O amido constitui o principal componente químico da farinha e caracteriza-se como um
NaOH + H3PO4 → Na3PO4 + H2O
Sabendo-se que Na=23, O=16, H=1 e P=31, qual a massa de ácido fosfórico (H3PO4) necessária para a obtenção de 200g de água?
A cadeia carbônica abaixo pode ser classificada como:
CH3 – CH2 – O – CH2 – CH3
Na situação de equilíbrio para a reação
2S02(g) + O2(g) ⇄ 2SO3(g)
as concentrações de reagentes e produtos a 1000 K foram determinadas como sendo [SO2] = 0.27 m ol.L-1, [O2] = 0.40 mol.L-1 e [SO3] = 0.33 m ol.L-1.
Na temperatura dada, o valor da constante de equilíbrio da
reação em termos de concentração será:
A calcinação de 2.8400 g de uma mistura sólida constituída de CaCO3 e MgCO3 produziu um gás e um resíduo sólido de peso 1.5200 g.
Com essas informações, é correto afirmar que
Dois elementos genéricos X e Y apresentam as seguintes distribuições eletrônicas por camadas: X(2, 8, 8, 1) e Y(2, 8, 18, 6). Considerando-se uma provável ligação química entre esses elementos (X e Y), afirma-se:
I O átomo X ganha 1 elétron e transforma-se em um cátion monovalente.
II A fórmula do composto formado é X2Y.
III A ligação que ocorre entre eles é do tipo iônica.
IV O átomo Y cede 2 elétrons e transforma-se em um ânion bivalente.
São corretas apenas as afirmações:
Para a remoção de um esmalte, um laboratório precisa preparar 200 mL de uma solução aquosa de propanona na concentração de 0,2 mol/L. Admita que a densidade da propanona pura é igual a 0,8 kg/L.
Nesse caso, o volume de propanona pura, em mililitros, necessário ao preparo da solução corresponde a:
No tratamento dos sintomas da acidez estomacal, emprega-se o hidróxido de alumínio, que neutraliza o excesso do ácido clorídrico produzido no estômago.
Na neutralização total, a quantidade de mols de ácido clorídrico que reage com um mol de hidróxido de alumínio para formação do sal neutro corresponde a: