Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
HgO(s) + Zn(s) + H2O(l) ↠ Zn(OH)2(aq) + Hg(l)
A partir dessas informações, assinale a afirmativa INCORRETA.
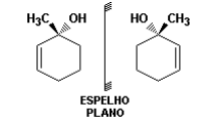
As duas estruturas mostradas representam:
I. Soluções ácidas são aquelas que têm pH < 6,5. II. Soluções neutras têm pH = 6,5 III. Soluções básicas têm pH > 6,5. IV. pH+pOH tem que ser igual a 13,0. V. Solução com pH = 14 é impossível de ser obtida.
Das afirmações anteriores estão CORRETAS:
HgO(s) + Zn(s) + H2O(l) → Zn(OH)2(aq) + Hg(l)
A partir dessas informações, assinale a afirmativa INCORRETA.
Cu2+(aq) + 2 e- → Cu (s)
A quantidade de elétrons, em mols, necessária para a obtenção de 254g de cobre puro é
I. 10g de NaCl em 100g de água. II. 10g de NaCl em 100ml de água. III. 20g de NaCl em 180g de água. IV. 10 mols de NaCl em 90 mols de água.
Destas soluções, tem concentração 10% em massa de cloreto de sódio:
Al+ 3 + 3e → Al (-1,66 V) Fe+2 + 2e → Fe (-0,44 V),
a ddp da pilha Al ; Al+3 ; Fe+2 ; Fe, em condições - padrão, é:
1. ponto de ebulição 2. Massa 3. Volume 4. densidade
Assinale as propriedades que podem permitir ao estudante a identificação desses líquidos.
O acarajé, preparado no óleo de dendê aquecido à ebulição, é um alimento rico em proteínas e carboidratos, de grande valor nutricional, que só a baiana do acarajé sabe preparar.
A partir dessa informação, é correto afirmar:
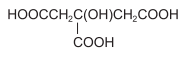
Ácido cítrico
A partir dessas informações, é correto afirmar:

De acordo com os estudos de Germain Henry Hess, professor da Universidade de São Petersburgo, no século XIX, a variação de entalpia em uma reação química depende apenas dos estados inicial e final de reagentes e de produtos da reação. A Lei de Hess contribuiu para o nascimento do princípio da conservação de energia.
A partir da aplicação da Lei de Hess, ao sistema de equações
termoquímicas I e II, é possível calcular a variação de entalpia
da reação representada pela equação química III.
Dessa forma, é correto afirmar:
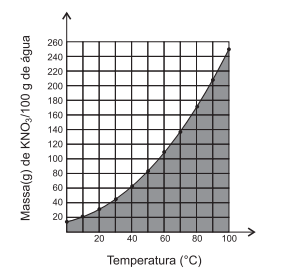
O gráfico representa a variação do coeficiente de solubilidade de nitrato de potássio com a temperatura.
Uma análise desse gráfico permite afirmar: