Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
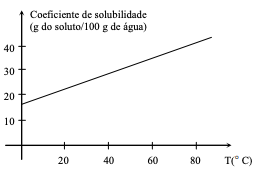
A partir dos dados constantes do gráfico, pode-se afirmar:
I - No metano (CH4) o carbono participa de quatro ligações covalentes polares. II - O diamante é uma das formas alotrópicas do carbono. III - Quando o carbono combina-se com elementos da família 17, forma compostos de fórmulas CX2, onde X representa um halogênio. IV - Os isótopos carbono 12 (C12) e carbono 13 (C13) apresentam os mesmos números de prótons e nêutrons em seus núcleos.
Estão corretas as afirmativas
( ) Os três compostos apresentam diferentes massas moleculares. ( ) Os três compostos possuem a fórmula molecular C4H10O. ( ) O composto III pertence à função ácido carboxílico. ( ) Apenas os compostos I e II apresentam carbonos secundários.
Assinale a seqüência correta.
Observe a reação a seguir:
5C6H12O6 + 24NO3 + 24H+ → 30CO2 + 42H2O + 12N2 + energia
Essa reação trata-se basicamente de um processo de respiração anaeróbica realizada por bactérias
ASSINALE o tipo de sistema produzido pelos componentes água e álcool e a forma de transmissão do calor do sol para esse sistema:
I - Partículas alfa, ao bombardearem uma fina folha de ouro, são desviadas de seu trajeto. Tudo leva a crer que os átomos presentes no metal possuem um núcleo denso e de carga positiva. II - Os átomos de determinado elemento químico são indivisíveis e idênticos em todas as suas propriedades. Átomos de elementos diferentes apresentam massas diferentes. III - Os elétrons presentes em um átomo movem-se em órbitas, em torno do núcleo, sem perder ou ganhar energia. Essas órbitas são denominadas camadas.
Essas proposições são atribuídas, respectivamente, ao cientistas:
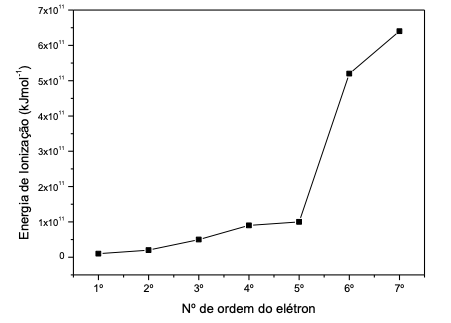
Esse gráfico refere-se ao elemento químico:
Considere a informação acima e o equilíbrio a seguir:
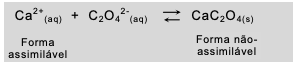
Esse equilíbrio está relacionado com as formas do cálcio assimilável pelo intestino humano e com as do não-assimilável. Uma quantidade elevada de alimentos ricos em oxalato dificulta a absorção de Ca2+ porque
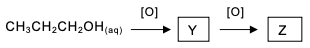
No esquema, as substâncias representadas por Y e Z são, respectivamente,

Um airbag é uma bolsa que infla rapidamente e que, num acidente de carro, ajuda a prevenir lesões graves, como mostra a figura ao lado. Quando se produz a desaceleração repentina do carro, é conectado automaticamente um interruptor, que inicia uma reação química, liberando o gás nitrogênio em quantidade suficiente, conforme a equação a seguir:
6 NaN3(l) + Fe2O3(s) 3 Na2O(s) + 2 Fe(s) + 9 N2(g)
Considere que o volume de um mol de gás, nas CNTP, corresponda a 22,4 litros. Nessas condições, de acordo com a equação química, quando reagem 3 moles de NaN3, o volume de nitrogênio gasoso que se obtém é, aproximadamente, de
Considere a tirinha a seguir.

FELTRE, Ricardo. Fundamentos da Química, volume único. São Paulo: Moderna, 1996. p.351. [Adaptado]
Aplicada ao equilíbrio químico, a idéia que o personagem tem sobre equilíbrio
Na preparação de uma solução diluída, com base em uma mais concentrada, retira-se um volume de solução concentrada de hidróxido de sódio (NaOH) 1 mol/L para se preparar 500 mL de uma solução diluída de 0,2 mol/L.
Se C1V1=C2V2, o volume inicial de solução de NaOH 1 mol/L retirado para se obter a solução diluída corresponderá a:
A seguir estão representadas quatro estruturas de substâncias.
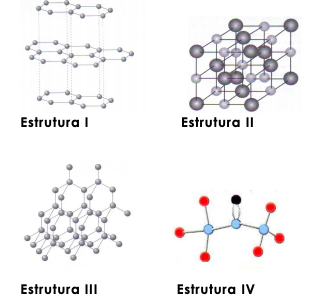
Considerando-se essas estruturas, é correto afirmar:
Um exemplo típico dessa colaboração é o uso, nos conversores catalíticos dos automóveis, de catalisadores, cuja função, nessa situação, é aumentar a velocidade da reação de poluentes produzidos pela combustão, transformando-os em substâncias menos poluentes, uma vez que
Ocorre um processo químico, por exemplo, quando
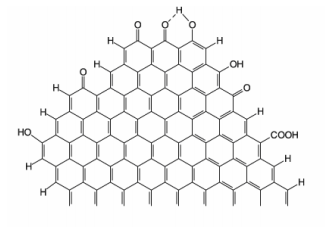
Assinale a alternativa que apresenta as funções orgânicas representadas na fórmula.