Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Durante décadas, o DDT(dicloro-difenil-tricloroetano) foi largamente usado como inseticida até ser comprovado que, além de provocar câncer, demora de 4 a 30 anos para se degradar. O DDT foi utilizado na Segunda Guerra Mundial para prevenção de tifo em soldados, que o utilizavam também para o combate a piolhos. Posteriormente foi usado na agropecuária, no Brasil e no mundo, dado seu baixo preço e elevada eficiência. Especialistas afirmam que o principal problema do DDT é sua ação indiscriminada, que atinge tanto as pragas quanto o resto da fauna e flora da área afetada. O DDT também se infiltra na água, contaminando os mananciais.

Durante décadas, o DDT(dicloro-difenil-tricloroetano) foi largamente usado como inseticida até ser comprovado que, além de provocar câncer, demora de 4 a 30 anos para se degradar. O DDT foi utilizado na Segunda Guerra Mundial para prevenção de tifo em soldados, que o utilizavam também para o combate a piolhos. Posteriormente foi usado na agropecuária, no Brasil e no mundo, dado seu baixo preço e elevada eficiência. Especialistas afirmam que o principal problema do DDT é sua ação indiscriminada, que atinge tanto as pragas quanto o resto da fauna e flora da área afetada. O DDT também se infiltra na água, contaminando os mananciais.

Durante décadas, o DDT(dicloro-difenil-tricloroetano) foi largamente usado como inseticida até ser comprovado que, além de provocar câncer, demora de 4 a 30 anos para se degradar. O DDT foi utilizado na Segunda Guerra Mundial para prevenção de tifo em soldados, que o utilizavam também para o combate a piolhos. Posteriormente foi usado na agropecuária, no Brasil e no mundo, dado seu baixo preço e elevada eficiência. Especialistas afirmam que o principal problema do DDT é sua ação indiscriminada, que atinge tanto as pragas quanto o resto da fauna e flora da área afetada. O DDT também se infiltra na água, contaminando os mananciais.

I - O DDT foi utilizado na Segunda Guerra Mundial como arma química devido ao efeito mortífero que esta substância provoca aos seres humanos causando sua morte por febre tifóide.
II - O DDT é uma substância muito instável. Mesmo a temperatura ambiente, ele sofre degradação térmica resultando no produto DDE.
III - O DDE apresenta quatro átomos de cloro e oito átomos de hidrogênio em sua estrutura.
IV - O DDT apresenta átomo de carbono assimétrico e, por conseqüência, atividade óptica.
Estão ERRADOS
Fritz Haber, prêmio Nobel de química em 1918, ficou famoso por causa da síntese da amônia a partir do nitrogênio atmosférico, alguns meses antes da Primeira Guerra Mundial (1914-1918). A produção inicial, entre três e cinco toneladas de nitrato, aumentou rapidamente com as contribuições de Carl Bosch: em 1918 ultrapassava 300.000 toneladas anuais. O processo Haber-Bosch é uma reação entre o nitrogênio e o hidrogênio para produzir amoníaco. Esta reação é catalisada com ferro, sob as condições de 200 atmosferas de pressão e uma temperatura de 450°C.
Fritz Haber, prêmio Nobel de química em 1918, ficou famoso por causa da síntese da amônia a partir do nitrogênio atmosférico, alguns meses antes da Primeira Guerra Mundial (1914-1918). A produção inicial, entre três e cinco toneladas de nitrato, aumentou rapidamente com as contribuições de Carl Bosch: em 1918 ultrapassava 300.000 toneladas anuais. O processo Haber-Bosch é uma reação entre o nitrogênio e o hidrogênio para produzir amoníaco. Esta reação é catalisada com ferro, sob as condições de 200 atmosferas de pressão e uma temperatura de 450°C.
( ) A amônia é classificada como um composto orgânico heterogêneo, pois apresenta o heteroátomo nitrogênio em sua estrutura.
( ) É quimicamente impossível obter-se ácido nítrico a partir da amônia, tendo em vista que esta ultima é uma base.
( ) Fritz Haber foi devidamente reconhecido como um importante químico para o mundo em seu tempo, chegando a ser congratulado em 1918 com o premio Nobel de química, devido à grande contribuição com a obtenção do Zyklon B e de outras substâncias de aplicações semelhantes.
( ) Uma grande importância da amônia nos tempos de Haber, assim como é ainda hoje, foi sua aplicação para a produção de produtos essenciais aos humanos, como os fertilizantes, hoje tão importantes para a produção de alimentos no mundo.
( ) O processo de produção da amônia desenvolvido por Haber e aperfeiçoado por Bosch teve influência direta na Primeira Guerra Mundial chegando a prolongá-la.
Indique a seqüência correta
Assinale a alternativa verdadeira.
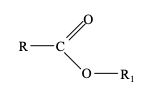
onde R e R1 são grupamentos carbonílicos de cadeias longas e não ramificadas. Sobre essas substâncias orgânicas, assinale a afirmativa INCORRETA.
( ) Se a marca 0 ºC e c marca 100 ºC, b pode representar a temperatura de um corpo humano febril. ( ) Se a marca b é alcançada quando o termômetro está em equilíbrio térmico com água a 4 ºC, é possível afirmar que a pode representar a temperatura da água a 3 ºC, se a substância X for o mercúrio. ( ) Se Tb > Ta, então, obrigatoriamente, Tc > Tb, independente da substância X.

Assinale a seqüência correta.
CH4 (g) + 2O2 (g) → CO2 (g) + 2 H2O(g)
Considere ainda os dados da tabela:
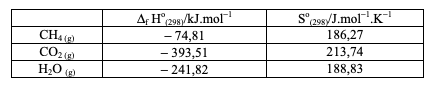
A partir das informações acima, pode-se afirmar:
I - 2 NaHCO3
 X + CO2 + H2O
II - X + Ca(OH)2 → 2 NaOH + Y
X + CO2 + H2O
II - X + Ca(OH)2 → 2 NaOH + Y Sobre esse processo, assinale a afirmativa correta.
Chumbo – tubos de raios-X e soldas; Arsênio – tubos de raios catódicos mais antigos; Cádmio – placas de circuitos e semi-condutores; Cromo – aços que receberam tratamento anti-ferrugem com cromo.
Assinale a alternativa que apresenta as fórmulas entre compostos de cada um dos elementos grifados e haletos (X− ).
Considere: 1 cal = 4,2J L = 540 cal/g
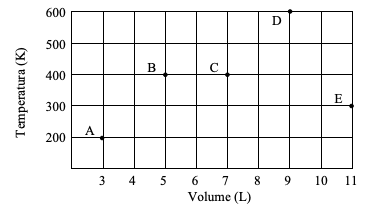
Considere essa massa de gás experimentando as seguintes transformações:
I - Estado inicial: A; Estado final: B. II - Estado inicial: A; Estado final: C. III - Estado inicial: A; Estado final: D. IV - Estado inicial: B; Estado final: D. V - Estado inicial: E; Estado final: A.
Assinale a transformação isobárica.
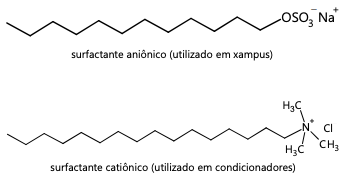
A mistura de produtos utilizados na fabricação de xampus e condicionadores é ineficiente para a produção do “xampu 2 em 1” devido:
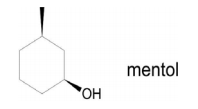
Considerando o exposto, o problema da obtenção de mentol sintético está relacionado ao fato de sua estrutura apresentar: