Questões de Vestibular
Sobre relações da química com as tecnologias, a sociedade e o meio ambiente em química
Foram encontradas 364 questões
Observe a foto, que mostra a grande diversidade fenotípica do ser humano.

Fonte: http://www.brasilescola.com/upload/e/diversidade%20cultural(1).jpg
Apesar das enormes diferenças entre os seres humanos, podemos afirmar que basicamente os elementos
químicos em maior porcentagem são sempre os mesmos. Quais são esses elementos químicos?
A partir da análise dos efeitos causados pelo cloreto de sódio sobre o aumento da pressão arterial no Brasil, é correto afirmar:
Uma análise dos aspectos de tratamento de água de esgotos de Correntina permite afirmar:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Bases são mais adequadas do que os ácidos, para remoção de gorduras em geral.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Recentemente a melamina foi utilizada de maneira criminosa na China para a adulteração do leite, pois a adição desse composto ao leite fazia aumentar o seu teor de nitrogênio.
O acarajé, preparado no óleo de dendê aquecido à ebulição, é um alimento rico em proteínas e carboidratos, de grande valor nutricional, que só a baiana do acarajé sabe preparar.
A partir dessa informação, é correto afirmar:

A mistura de dihidrogeno-pirofosfato de sódio com hidrogenocarbonato de sódio, de acordo com a equação química, é utilizada como fermento químico na produção industrial de bolos, pães e biscoitos. Essa é uma forma rápida de fazer expandir, durante o aquecimento, a massa para o preparo desses alimentos, em relação à utilizada com fermento biológico.
Considerando-se essas informações, é correto afirmar:
Um indicador de poluição difusa de água subterrânea é o nitrato. Sua origem está relacionada a atividades agrícolas e esgotos sanitários. Sendo o nitrato uma forma estável de nitrogênio em condições anaeróbias, esta substância pode ser considerada persistente e sua remoção da água, para atender ao padrão de potabilidade que é de 10 mg/L, é onerosa e, por vezes, tecnicamente inviável, prejudicando o abastecimento público e privado.
Disponível em: <http://www.cetesb.sp.gov.br/Solo/agua_sub/poluicao.asp> Acesso em: 03 set. 2010. (Adaptado)
Considere as seguintes reações utilizadas para a determinação de nitrato.
Sobre o assunto e as reações acima, assinale a proposição CORRETA.
Apesar de ser um dos metais mais tóxicos, o cádmio é bastante utilizado na fabricação de
baterias.

Texto I:
Matar ou morrer
Ao longo dos anos, tem-se tornado cada vez mais necessário aumentar a produtividade agrícola, visando à produção de alimentos. Já nos ambientes urbanos, o controle dos diversos tipos de pragas e insetos é fundamental para a garantia da saúde pública. Para esses fins, passou-se a utilizar, cada vez mais, não só fertilizantes, como também pesticidas, incluindo os inseticidas, herbicidas e fungicidas. Dentre os inseticidas, a Deltametrina é amplamente utilizada no controle de pragas de diversas culturas, no combate de insetos domésticos, dentre outros. O amplo uso da Deltametrina justifica-se por sua potente ação inseticida, toxicidade relativamente baixa em mamíferos e persistência limitada no meio ambiente. Algumas de suas características físicas e químicas estão listadas na tabela abaixo:
TABELA - Características físicas e químicas da Deltametrina
Estado físico pó cristalino
Cor sem cor
Odor sem odor
Densidade (20 ºC) 0,5 g/cm3
Massa Molar 505,24 g/mol
Ponto de fusão 98 – 101 ºC
Ponto de ebulição acima de 300 ºC
Solubilidade em água (20 ºC) < 0,002 mg/L
Solubilidade em solventes orgânicos Solúvel
Solubilidade em Acetona 500 g/L
FONTE: WHO - WORLD HEALTH ORGANIZATION. Environmental Health Criteria 97 – Deltamethrin. Geneva: International Program on Chemical Safety - IPCS, 1990.
A formula estrutural da Deltametrina é apresentada na figura abaixo:

Comumente, a indústria química comercializa o inseticida Deltametrina com as seguintes especificações:
cada 1000 mL contém:
Deltametrina..............25 g
Veículo q.s.p.............1000 mL
No rótulo desse produto há também recomendações para dilução em água para sua aplicação final, de acordo com a tabela abaixo.
Quantidade de água Moscas Insetos rasteiros
1 litro 6 mL 8 mL
10 litros 60 mL 80 mL
20 litros 120 mL 160 mL
Responda a questão com base nas informações dadas sobre o tema “inseticidas” e em seus conhecimentos
de química.
I - O uso da água como solvente para diluição do inseticida Deltametrina, citado no texto I, tem a vantagem econômica de ser barata e acessível. No entanto, o inseticida não formará uma solução em água, dada sua baixa solubilidade nesse meio. II - Utilizando-se a acetona como solvente tem-se a vantagem desta dissolver bem a Deltametrina, de modo a formar uma solução. No entanto, a acetona, além de ser bem mais cara que a água, também é inflamável. Portanto, por questões econômicas e de segurança, o uso desse solvente é não recomendável para diluição do inseticida. III - A Deltametrina mata os insetos principalmente pelo seu mau cheiro, o que provoca sufocamento nos mesmos.
Está(ão) correta(s) a(s) afirmativa(s):
Texto I:
Matar ou morrer
Ao longo dos anos, tem-se tornado cada vez mais necessário aumentar a produtividade agrícola, visando à produção de alimentos. Já nos ambientes urbanos, o controle dos diversos tipos de pragas e insetos é fundamental para a garantia da saúde pública. Para esses fins, passou-se a utilizar, cada vez mais, não só fertilizantes, como também pesticidas, incluindo os inseticidas, herbicidas e fungicidas. Dentre os inseticidas, a Deltametrina é amplamente utilizada no controle de pragas de diversas culturas, no combate de insetos domésticos, dentre outros. O amplo uso da Deltametrina justifica-se por sua potente ação inseticida, toxicidade relativamente baixa em mamíferos e persistência limitada no meio ambiente. Algumas de suas características físicas e químicas estão listadas na tabela abaixo:
TABELA - Características físicas e químicas da Deltametrina
Estado físico pó cristalino
Cor sem cor
Odor sem odor
Densidade (20 ºC) 0,5 g/cm3
Massa Molar 505,24 g/mol
Ponto de fusão 98 – 101 ºC
Ponto de ebulição acima de 300 ºC
Solubilidade em água (20 ºC) < 0,002 mg/L
Solubilidade em solventes orgânicos Solúvel
Solubilidade em Acetona 500 g/L
FONTE: WHO - WORLD HEALTH ORGANIZATION. Environmental Health Criteria 97 – Deltamethrin. Geneva: International Program on Chemical Safety - IPCS, 1990.
A formula estrutural da Deltametrina é apresentada na figura abaixo:

Comumente, a indústria química comercializa o inseticida Deltametrina com as seguintes especificações:
cada 1000 mL contém:
Deltametrina..............25 g
Veículo q.s.p.............1000 mL
No rótulo desse produto há também recomendações para dilução em água para sua aplicação final, de acordo com a tabela abaixo.
Quantidade de água Moscas Insetos rasteiros
1 litro 6 mL 8 mL
10 litros 60 mL 80 mL
20 litros 120 mL 160 mL
Responda a questão com base nas informações dadas sobre o tema “inseticidas” e em seus conhecimentos
de química.
I - O uso de inseticidas pode e deve ser banido das diversas atividades humanas uma vez que esses produtos têm impactos diretos no problema do aquecimento global II - Espera-se que a Deltametrina tenha grande influência também no buraco da camada de ozônio, uma vez que os átomos de bromo de sua estrutura têm as mesmas propriedades dos átomos de cloro dos CFCs (os CloroFluoro-Carbonetos), poderosos agentes impactantes dessa região atmosférica. III - Os inseticidas, principalmente quando usados de forma indevida, acumulam-se no solo, e os animais se alimentam da vegetação contaminada prosseguindo o ciclo de contaminação. Também, com as chuvas, os produtos químicos usados na composição dos pesticidas infiltram no solo, contaminando os lençóis freáticos, e acabam escorrendo para os rios continuando, assim, a contaminação.
Está(ão) correta(s):
DADOS QUE PODERÃO SER UTILIZADOS
NA QUESTÃO DE QUÍMICA

Constante Universal dos Gases
Perfeitos: 0,082 atm.L/mol.K
DADOS QUE PODERÃO SER UTILIZADOS
NA QUESTÃO DE QUÍMICA

Constante Universal dos Gases
Perfeitos: 0,082 atm.L/mol.K
Os extintores de incêndio à base de espuma contêm soluções aquosas de sulfato de alumínio e bicarbonato de sódio. Sobre a chama ocorre a reação cuja equação não balanceada é:
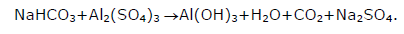
Com relação a reação anterior e seus efeitos
sobre a chama, assinale a afirmação FALSA.
DADOS QUE PODERÃO SER UTILIZADOS
NA QUESTÃO DE QUÍMICA

Constante Universal dos Gases
Perfeitos: 0,082 atm.L/mol.K
Ao entrar na sua sala de aula, um aluno de química foi surpreendido pelo teor de algumas frases sobre variados temas da química.
I - O metano, um gás estufa, é gerado por queima de biomassa, pecuária, depósito de lixo, etc.
II - Os metais alcalino-terrosos são também conhecidos como terras raras.
III - Os produtos naturais não causam danos à saúde.
IV - Misturas e substâncias diferem entre si porque as primeiras não obedecem à lei de Proust.
V - As leis de Faraday tratam apenas de aspectos qualitativos da eletrólise.
São verdadeiras as afirmações
Considerando-se a problemática do lixo das grandes regiões metropolitanas do país, dentre as soluções corretas para reduzir o acúmulo desse material nos aterros sanitários, pode-se incluir
A construção do Castelo Garcia D’Ávila esteve associada a uma série de problemas, entre os quais é correto destacar: