Questões de Vestibular de Química - Representação das transformações químicas
Foram encontradas 203 questões
No ano de 2014, o Estado de São Paulo vive uma das maiores crises hídricas de sua história. A fim de elevar o nível de água de seus reservatórios, a Companhia de Saneamento Básico do Estado de São Paulo (Sabesp) contratou a empresa ModClima para promover a indução de chuvas artificiais. A técnica de indução adotada, chamada de bombardeamento de nuvens ou semeadura ou, ainda, nucleação artificial, consiste no lançamento em nuvens de substâncias aglutinadoras que ajudam a formar gotas de água.
(http://exame.abril.com.br. Adaptado.)
Para a produção de chuva artificial, um avião adaptado pulveriza gotículas de água no interior das nuvens. As gotículas pulverizadas servem de pontos de nucleação do vapor de água contido nas nuvens, aumentando seu volume e massa, até formarem gotas maiores que, em condições meteorológicas favoráveis, podem se precipitar sob a forma de chuva.
Segundo dados da empresa ModClima, dependendo das condições meteorológicas, com 1 L de água lançada em determinada nuvem é possível produzir o volume equivalente a 50 caminhões-pipa de água precipitada na forma de chuva. Sabendo que um caminhão-pipa tem capacidade de 10 m3 , a quantidade de chuva formada a partir de 300 L de água lançada e a força intermolecular envolvida na formação das gotas de chuva são, respectivamente,
Dados de massas molares em g mol-1 : C=12; N=14 e O=16.
CH3OH(g)+ 3/2 O2(g) → CO2(g) + 2 H2O(g) combustão direta
CH3OH(g)+H2O(g) → CO2(g) + 3H2(g) H2(g)+ ½ O2(g) → H2O(g) geração e queima de hidrogênio
De acordo com essas equações, o processo de geração e queima de hidrogênio apresentaria uma variação de energia
Dados: Equação da reação: ½ N2 + O2 → NO2
Massas molares em g mol-1: N2=28 , O2=32 e NO2= 46
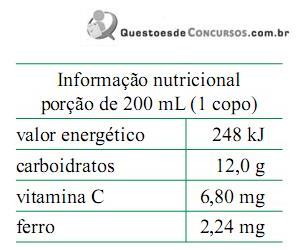
Dada a constante de Avogadro, 6,0 × 1023 mol-1, é correto afirmar que 1 litro desse suco contém um número total de espécies de ferro, massa molar 56 g· mol-1, igual a
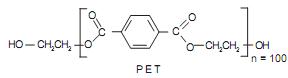
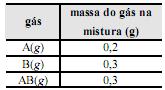
é correto afirmar que
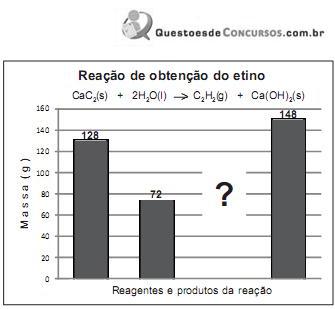
A massa, em gramas, de etino obtido nessa reação, que corresponde à coluna representada pelo ponto de interrogação, é

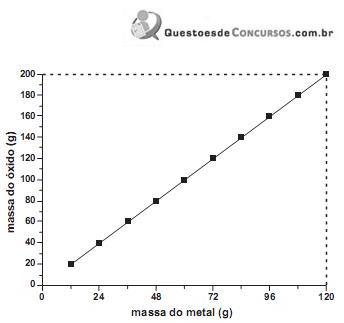
Durante um experimento, realizado em recipiente fechado, foi colocado para reagir 1,00 g do referido metal, obtendo-se 1,40 g do seu óxido. Considerando-se que todo o oxigênio presente no frasco foi consumido, pode-se determinar que a massa de oxigênio presente no sistema inicial é x . Em outro recipiente fechado, foram colocados 1,50 g do referido metal em contato com 1,20 g de oxigênio. Considerando que a reação ocorreu até o consumo total de pelo menos um dos reagentes, pode- se afirmar que amassa de óxido gerado é y . Sabendo que ometal emquestão forma apenas um cátion estável e considerando que em todas as reações o rendimento foi de 100 %, os valores de x e y são, respectivamente,
Se a massa de CO2 produzida foi 13,9 g, a quantidade em mol de CO é:
B2O3 + 3Mg → 2B + 3MgO
Partindo-se de 262,5 g do óxido de boro em excesso de magnésio, obteve- se 33 g de B, o que significa que o rendimento percentual (%) da reação foi mais próximo de:

A partir das informações acima, e considerando o número de Avogadro igual a 6 × 1023, julgue os itens seguintes.

Considerando as informações acima, julgue os itens 50 e 51, assinale a opção correta no item 52, que é do tipo C, e faça o que se pede no item 53, que é do tipo D.