Questões de Vestibular
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 329 questões
I. CaC2(s) + N2(g) 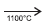 CaNCN(s) + C(s)
CaNCN(s) + C(s)
II. CaNCN(s) + 5H2O(ℓ) → CaCO3(s) + 2NH4OH(aq)
Quando carbeto de cálcio, CaC2, é aquecido em um forno elétrico, na presença de nitrogênio atmosférico, a 1100ºC, dá origem à cianamida de cálcio, empregada largamente como fertilizante nitrogenado de ação lenta, pois leva alguns meses, no solo, para se hidrolisar de acordo com a equação química II. Como a cianamida de cálcio não é arrastada pelas chuvas, é um fertilizante melhor do que o nitrato de amônio, NH4NO3, e a ureia, CO(NH2)2.
Uma análise dessas informações permite afirmar:
Os trabalhos do químico alemão Friedrich Willhelm Ostwald sobre a relação matemática entre constante de ionização, Ka, com o grau de ionização, α, e com a concentração em mol.L−1 , m, de um ácido fraco ficaram conhecidos como a Lei de diluição de Ostwald, representada pela expressão Ka= a2 .m/ 1 - α. As suas pesquisas levaram-no ao recebimento, em 1909, do prêmio Nobel de Química.
A partir dessas informações e da reação de ionização do ácido hipobromoso, em uma solução 0,1 molar desse ácido, representada pela equação química, é correto afirmar:
Para explorar convenientemente a cultura da soja, é indispensável incorporar calcário aos solos que estão com pH inferior a 5,5. A quantidade de calcário a ser aplicada no terreno é determinada através da análise do solo.
Considerando-se essas informações, é INCORRETO afirmar que
 Kb = 2,0x10-12
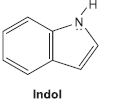
Kb = 2,0x10-12O indol tem odor semelhante à essência floral, quando bastante diluído em etanol, e odor muito forte, quando em solução etanólica concentrada.
Considerando-se essas informações, é correto afirmar que o indol
Se dissolvidos em água, os ácidos carboxílicos e fenóis originam soluções ácidas; as aminas, nas mesmas condições, originam soluções básicas.
I. CH3 -COOH
II. HCHO
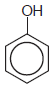
III.
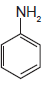
IV.
V. CH3 –
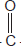 – NH2
– NH2
As substâncias que originam soluções com pH<7, quando dissolvidas em água, são, apenas,
Pesquisadores descobriram que os atletas que bebem água somente para saciar a sede, sem considerar a água perdida pelo suor nos exercícios, apresentam resistência física menor quando comparados àqueles que consomem água em quantidade adequada. Por outro lado, atletas que bebem mais água têm mais disposição física e sua temperatura corporal permanece perto da normal, pois o corpo utiliza a água para manter adequado o pH dos fluidos biológicos também, o equilíbrio químico das substâncias do organismo.
Já o consumo de outras bebidas, como sucos e refrigerantes, não provoca o mesmo efeito que o consumo de água. Essas bebidas, além de outras substâncias, contêm açúcar, o qual pode retardar a digestão, contribuir para o ganho de peso e provocar oscilação nos níveis de glicose do organismo. Além disso, os refrigerantes do tipo “cola” possuem, em sua composição, ácido fosfórico (H3 PO4) que pode prejudicar o teor de cálcio no corpo, pois os ânions oriundos da ionização do ácido fosfórico reagem com o cálcio dos ossos, enfraquecendo-os. O ácido fosfórico é um poliácido e suas constantes de ionização são iguais a: K1 = 7,5 x 10-3, K2 = 6,2 x 10-8 e K3 = 5,0 x 10-13.Se não tomarmos água suficiente, os rins têm de trabalhar mais arduamente para eliminar substâncias tóxicas do organismo. A quantidade adequada de água ingerida pode ser verificada, grosso modo, pela perda acentuada da cor amarela característica da urina.
A partir do texto, assinale a alternativa correta.
Em um experimento, uma pequena amostra de soro sanguíneo foi colocada em um suporte poroso embebido em meio formado por solução salina mantida em pH 6,0. Através desse suporte estabeleceu-se um circuito elétrico, como mostra o esquema abaixo.

|
Proteína |
pI (valores médios) |
|
|
nome |
velocidade de migração |
|
|
gamaglobulina |
v1 |
8,0 |
|
betaglobulina |
v2 |
7,6 |
|
alfaglobulina |
v3 |
6,6 |
|
albumina |
v4 |
4,8 |
A ordem crescente das velocidades de migração das proteínas citadas é:
A cor das flores de diversas plantas ocorre devido à presença de substâncias, como as antocianinas, que atuam como indicadores ácido-base. Assim, conforme o pH do solo, a cor das flores pode variar. É o caso das hortênsias, que apresentam cor azul em solos ácidos e rosa em solos alcalinos.
Caso uma pessoa queira cultivar hortênsias de cor rosa, em um jardim cujo solo seja ácido, ela deverá corrigir o pH e, para isso, poderá misturar à terra, em quantidade adequada,
Com base nessas informações, é correto afirmar que:
I. A adição de algumas gotas de fenolftaleína a amostras de cada solução fez com que apenas a amostra de B se tornasse rosada.
II. A solução rosada, obtida no ensaio I, tornou-se incolor pela adição de amostra de A.
III. Amostras de A e C produziram precipitados brancos quando misturadas, em separado, com amostras de D.
Com base nessas observações e sabendo que sulfatos de metais alcalino-terrosos são pouco solúveis em água, pode-se concluir que A, B, C e D são, respectivamente, soluções aquosas de
Frasco 1: 100 mL de H2O( L )
Frasco 2: 100 mL de solução aquosa de ácido acético de concentração 0,5 mol/L
Frasco 3: 100 mL de solução aquosa de KOH de concentração 1,0 mol/L
Frasco 4: 100 mL de solução aquosa de
 de concentração 1,2 mol/L
de concentração 1,2 mol/L
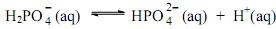
Se no equilíbrio foram medidas as concentrações molares
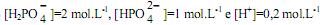 , o valor da constante de equilíbrio é:
, o valor da constante de equilíbrio é: 

