Questões de Vestibular
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 329 questões
Disponível em: (Adaptado) Acesso em 07 - jun-2011.
(Dados - massas molares: Na = 23g/mol; H = 1g/mol; O = 16g/mol; C = 12g/mol; S = 32g/mol)
De acordo com o texto e com os seus conhecimentos, é correto afirmar que:
A partir da compreensão dessa informação, é correto afirmar:
Al2(SO4)3 + 6H2O → 2Al(OH)3 + 6 H+ + 3SO42-
O excesso de íons H+ formado tende a diminuir o pH do meio, o que pode contribuir para a interrupção da formação do Al(OH)3, atrapalhando o processo de coagulação/floculação. Em alguns casos, o excesso de H+ é removido pela alcalinidade presente nas águas naturais. Se a alcalinidade do meio não for suficiente, o pH deve ser aumentado pela adição de outras substâncias. Disponível em: <http://qnesc.sbq.org.br/online/cadernos/01/aguas.pdf> Acesso em: 1 nov. 2011 (adaptado).
É possível aumentar o pH do meio aquoso adicionando-se a seguinte substância:
Com base nos dados da tabela, pode-se afirmar que apenas
CH3COOH(aq) + H2O(l) ⇌ CH3COO− (aq) + H+ (aq)
Equilíbrio iônico é o caso particular de equilíbrio químico em que aparecem íons. Os íons estão presentes em várias soluções aquosas encontradas na natureza e nos organismos dos seres vivos. Dos equilíbrios químicos iônicos em solução aquosa, um dos mais importantes é o que ocorre na ionização de ácidos e de bases. A concentração desses íons depende, entre outros fatores, do grau de ionização, α, e do valor da constante de ionização, Ka.
Desse modo, considerando-se uma solução de ácido acético 0,02 mol L−1 , cujo grau de ionização, α, é igual a 3%, em equilíbrio químico representado pela equação química, é correto afirmar:
Cultura: Arroz | pH médio: 5,0 Cultura: Café | pH médio: 6,0 Cultura: Milho | pH médio: 7,0
Daí a necessidade, em muitas ocasiões, de corrigir o pH do solo com a adição de calcário (carbonato de cálcio). Sobre a correção do solo e o cultivo dos alimentos, assinale a alternativa correta.
A reação de escurecimento em frutas, vegetais e sucos de frutas é um dos principais problemas na indústria de alimentos. Estima-se que em torno de 50% da perda de frutas tropicais no mundo é devida à enzima polifenol oxidase – PFO, que provoca a oxidação dos compostos fenólicos naturais presentes nos alimentos, causa a formação de pigmentos escuros – frequentemente acompanhados de mudanças indesejáveis na aparência e nas propriedades organolépticas do produto – resultando na diminuição da vida útil e do valor de mercado.
Várias maneiras de inibição da polifenol oxidase são conhecidas. Essa inibição é desejável e muitas vezes necessária para evitar o aparecimento de sabor desagradável e toxidez, como também por questões econômicas. Três componentes devem estar presentes para que a reação de escurecimento enzimático ocorra: enzima, substrato e oxigênio. No caso de ausência ou bloqueio da participação de um destes na reação química (seja por agentes redutores, diminuição de temperatura ou abaixamento de pH), a “velocidade” de reação diminui significativamente. O pH ótimo de atuação da PFO está entre 6 e 7, e abaixo de 3 não há nenhuma atividade enzimática.”
Adaptado de CARVALHO; LUPETTI; FATIBELLO-FILHO. Química Nova na Escola, n. 22, 2005.
A partir da leitura do texto acima e considerando as contribuições da ciência e tecnologia no campo da produção alimentícia, assinale a alternativa correta.
Determinou-se experimentalmente as concentrações de íons H+ e de íons OH- na água pura, no vinagre e em uma solução de limpeza com amônia, todos a 25˚C, obtendo-se os seguintes dados:
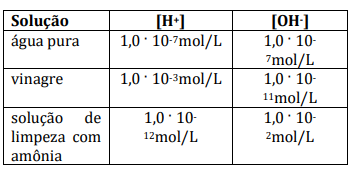
Assinale a alternativa correta.
I. Quando dissolvidos em água, os gases CO2, SO2, SO3 e HCl geram soluções eletrolíticas cujo pH é menor que 7.
II. As moléculas de CO2, SO2 e H2O apresentam geometria linear.
III. No estado sólido, as moléculas de CO2 encontram-se atraídas entre si por ligações de hidrogênio muito intensas.
É correto o que se afirma em:

Pela análise do texto, é correto afirmar que
Três amostras líquidas, identificadas pelas letras A, B e C, foram testadas por meio de indicadores ácido- base. Os resultados são apresentados no quadro a seguir:
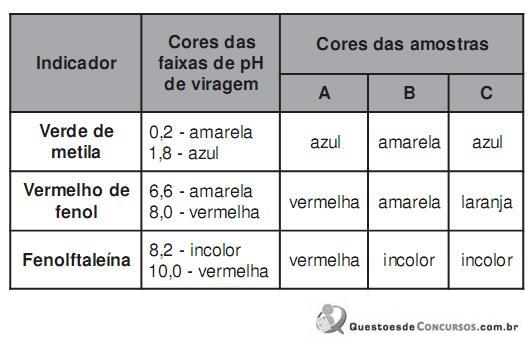
A análise dos resultados permite concluir que as amostras A, B e C são, respectivamente,
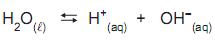
O produto iônico da água é
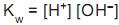 , cujo valor é 1 x
, cujo valor é 1 x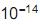 a 25 °C. Ao se adicionar 1,0 mL de NaOH 1,0 mol/L (base forte) a um copo bécher contendo 99 mL de água pura, o pH da solução será aproximadamente igual a
a 25 °C. Ao se adicionar 1,0 mL de NaOH 1,0 mol/L (base forte) a um copo bécher contendo 99 mL de água pura, o pH da solução será aproximadamente igual a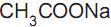 ) e ácido acético (
) e ácido acético (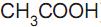 ). O pH desse tampão pode variar de 4,0 a 5,4 de acordo com a proporção dessa mistura.
). O pH desse tampão pode variar de 4,0 a 5,4 de acordo com a proporção dessa mistura. Sobre o tampão acetato, é ERRADO afirmar que:
Analise as proposições a seguir:
I. Um dos componentes mais importantes do xampu são os surfactantes, substâncias responsáveis pela eliminação da oleosidade, atuando pela interação entre a gordura, o xampu e a água mediante ligações intermoleculares.
II. Para garantir o pH do xampu por volta de 6, valor próximo ao pH do cabelo, o ácido cítrico pode ser utilizado, o que indica que nestes produtos a concentração hidrogeniônica é da ordem de 1,0 x 10-6 mol/L.
III. Os xampus destinados ao uso infantil contêm surfactantes-anfotéricos (estrutura a seguir), que em meio ácido captura o íon H+ , e em solução básica liberam um dos hidrogênios ligados ao nitrogênio, o que os tornam menos irritantes aos olhos.
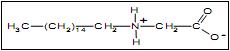
IV. Ao utilizarmos um xampu formado por surfactante aniônico, e não enxaguarmos adequadamente para remover todo o produto usado na lavagem, parte desse ficará aderida aos cabelos e o atribuirão cargas negativas que causam repulsão entre eles, sendo indicado para diminuir essa repulsão, o uso de condicionadores por apresentarem na sua composição substâncias com cargas positivas.
É CORRETO o que se afirma em:

Considerando-se, por exemplo, que um solo ideal para a cultura da soja necessite de um pH= 5,0, este solo possuirá uma concentração de íons Hidrogênio (H+ ) e pOH, respectivamente iguais a:
Caso pKa = - log Ka , em que Ka é a constante de dissociação ácida do AAS, seja igual a 3,5, então a aspirina será mais bem absorvida pelo epitélio do estômago, onde o pH médio é 2, que pelo duodeno, onde o pH médio é 8.
Sabe-se que o pH de alvejantes formados por soluções aquosas de hipoclorito de sódio é superior a 7. Isso se deve ao fato de o NaClO, ao reagir com a água, produzir o ácido hipocloroso (HClO), o que aumenta a razão [OH- ]/[H3O+ ] no meio.


