Questões de Vestibular
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 333 questões
Caso pKa = - log Ka , em que Ka é a constante de dissociação ácida do AAS, seja igual a 3,5, então a aspirina será mais bem absorvida pelo epitélio do estômago, onde o pH médio é 2, que pelo duodeno, onde o pH médio é 8.
Sabe-se que o pH de alvejantes formados por soluções aquosas de hipoclorito de sódio é superior a 7. Isso se deve ao fato de o NaClO, ao reagir com a água, produzir o ácido hipocloroso (HClO), o que aumenta a razão [OH- ]/[H3O+ ] no meio.

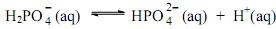
Se no equilíbrio foram medidas as concentrações molares
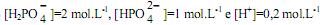 , o valor da constante de equilíbrio é:
, o valor da constante de equilíbrio é: NaOH 5,6 mol.L-1 e ao qual foi adicionado 150 mL de uma solução de HCl 2,0 mol.L-1 . A solução resultante dessa mistura deverá apresentar um pH:
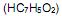 com o hidróxido de sódio. Se em uma solução aquosa 0,072 mol/L de ácido benzóico, no equilíbrio apresenta uma concentração de íons hidrônio
com o hidróxido de sódio. Se em uma solução aquosa 0,072 mol/L de ácido benzóico, no equilíbrio apresenta uma concentração de íons hidrônio 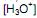 de 2,1 x 10-3 mol/L, qual é o valor de
de 2,1 x 10-3 mol/L, qual é o valor de 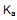 (constante de ionização ácida) deste ácido?
(constante de ionização ácida) deste ácido?PbS (s) ⇄ Pb2- (aq) + S2- (aq) S2- (aq) + 2 H- (aq)⇄ H2S (aq)
Neste gráfico, estão representadas as concentrações de Pb 2+ e S 2– , originadas exclusivamente do PbS, em função do pH da água:
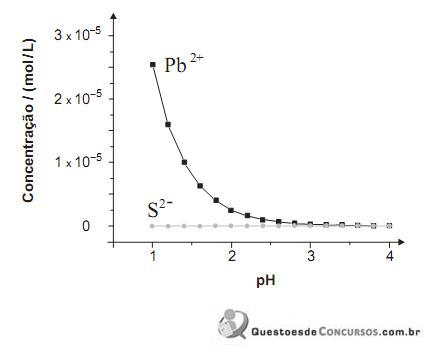
Considere que a incidência de chuva ácida sobre o mesmo lago altera a concentração das espécies envolvidas nos dois equilíbrios.
Com base nessas informações, é CORRETO afirmar que, na situação descrita,
Nos três casos, ocorreu reação química e observou-se a formação de bolhas.
Ao final das reações, as três soluções tornaram-se cor-de-rosa.
O tempo necessário para que cada uma dessas reações se complete está registrado neste quadro:
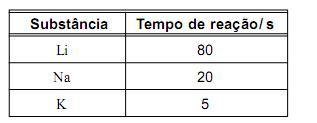
Considerando-se essas informações, é INCORRETO afirmar que
Analise estas três afrmativas concernentes a esse sistema:
I. O sistema é ácido.
II. O pH do sistema é maior que 7.
III. No sistema, a concentração dos íons H+ é maior que a dos OH– .
A partir dessa análise, é CORREtO afrmar que
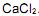 Esses dois métodos fornecem valores diferentes de pH, nos quais o pH em água é maior em relação ao pH em
Esses dois métodos fornecem valores diferentes de pH, nos quais o pH em água é maior em relação ao pH em 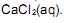 Esse fato ocorre porque
Esse fato ocorre porque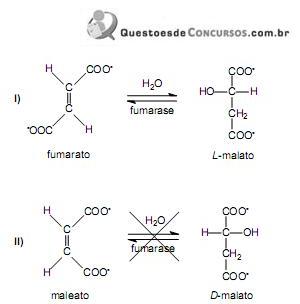
A reação representada em II não ocorre porque
 (aq), adicionou-se água pura, em quantidade sufciente para se obterem 100,0 mL de solução diluída.
(aq), adicionou-se água pura, em quantidade sufciente para se obterem 100,0 mL de solução diluída.Considerando-se essas informações, é CORRETO afrmar que o pH da solução resultante é
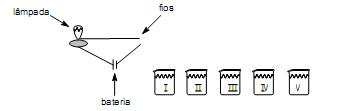
Sabe-se que, no caso dos ácidos, quanto maior o grau de ionização, maior a intensidade da luz emitida pela lâmpada. Ao se realizar o teste de condutividade com as cinco soluções de mesma concentração, preparadas com ácidos (I, II, III, IV e V), observaram-se diferentes intensidades luminosas, ao se mergulhar os fios nas soluções. Considere os seguintes valores de pKa para os ácidos.
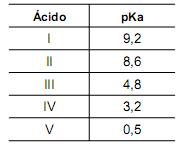
Analisando-se os dados de pKa, conclui-se que a maior luminosidade foi observada quando os fios foram colocados na solução do ácido
Concentração de ácido acético: 6,0% m/V.
Ao explicar que o vinagre é uma solução aquosa de ácido acético (ácido etanóico), o professor deixou o seguinte questionamento valendo um ponto na média: “Qual o pH do vinagre?”
As seguintes informações foram fornecidas pelo professor:
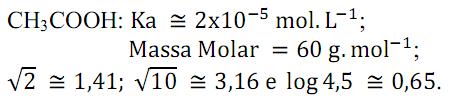
Assim, ganhará o ponto o aluno que responder que o pH é aproximadamente:


