Questões de Vestibular
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 448 questões
1. Adição de 20 mL de água a uma solução aquosa saturada em cloreto de sódio, contendo um grande excesso de sal sedimentado, tal que ainda permaneça precipitado após a adição de mais solvente. 2. Adição de 20 mL de água a uma solução aquosa não saturada em cloreto de sódio. 3. Retirada de fenol, solúvel em água e em éter etílico, de uma solução aquosa, por agitação com uma porção de éter etílico seguida por separação da fase orgânica da fase aquosa. 4. Dissolver glicose em água e a esta solução juntar etanol para que surjam novamente cristais de glicose. 5. Adição de 20 mL de água a nitrato de potássio cristalino.
a) Dissolução b) Extração c) Diluição d) Recristalização
100g de uva passa são processados adequadamente até se obterem 280ml de solução que contêm 0,975mg de um sal de potássio, K2A, 100% dissociado. A molaridade dos íons potássio, em mols por litro, é: Dado: massa molar K2A = 174g/mol
I. 10g de NaCl em 100g de água. II. 10g de NaCl em 100ml de água. III. 20g de NaCl em 180g de água. IV. 10 mols de NaCl em 90 mols de água.
Destas soluções, tem concentração 10% em massa de cloreto de sódio:
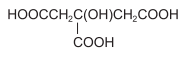
Ácido cítrico
A partir dessas informações, é correto afirmar:
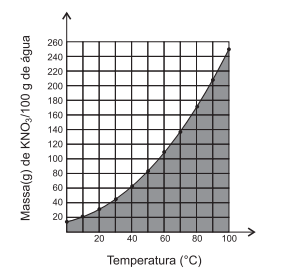
O gráfico representa a variação do coeficiente de solubilidade de nitrato de potássio com a temperatura.
Uma análise desse gráfico permite afirmar:
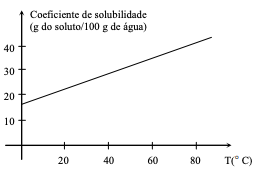
A partir dos dados constantes do gráfico, pode-se afirmar:
Na preparação de uma solução diluída, com base em uma mais concentrada, retira-se um volume de solução concentrada de hidróxido de sódio (NaOH) 1 mol/L para se preparar 500 mL de uma solução diluída de 0,2 mol/L.
Se C1V1=C2V2, o volume inicial de solução de NaOH 1 mol/L retirado para se obter a solução diluída corresponderá a:
I - Colocando-se, em água, uma quantidade de sal superior à sua solubilidade, obtém-se uma solução saturada em equilíbrio com a porção do sal não dissolvida, formando um sistema homogêneo. II - Detecta-se experimentalmente que as concentrações dos íons H3O+ e OH− para as soluções salinas podem ou não ser alteradas em relação às da água pura e que soluções de cloreto de amônio (NH4Cl) são alteradas, com a concentração de H3O+ aumentando e de OH− diminuindo, assim, tem-se que soluções de cloreto de amônio são ácidas. III - Sais que formam soluções básicas têm um ânion capaz de reagir com a água, alterando, para maior, a concentração do íon OH− . IV - A reação de hidrólise de qualquer sal ocorre sempre com a formação de um ácido ou uma base fraca.
Estão corretas as afirmativas
Um estudante de química prepara 1 litro de cada solução aquosa abaixo.
Solução I: Cloreto de sódio (NaCl): 0,26 molar
Solução II: Nitrato de cálcio [Ca(NO3)2]: 0,15 molar
Solução III: Sulfato de alumínio [Al2(SO4)3]: 0,11 molar
A relação entre as massas dos cátions presentes nas soluções é bem
próxima de:
A tartrazina é uma substância muito utilizada para colorir alimentos. No entanto, estudos apresentam a ocorrência de alergias principalmente em pessoas sensíveis ao ácido acetilsalicílico, porém sem resultados conclusivos. Para efeito da utilização da tartrazina como aditivo alimentar, a Agência Nacional de Vigilância Sanitária (ANVISA) define seu limite máximo de 30 mg por 100 gramas de amostra e um IDA (Ingestão Diária Aceitável) de 7,5 mg/Kg de peso corpóreo para tartrazina.
A tartrazina é uma substância muito utilizada para colorir alimentos. No entanto, estudos apresentam a ocorrência de alergias principalmente em pessoas sensíveis ao ácido acetilsalicílico, porém sem resultados conclusivos. Para efeito da utilização da tartrazina como aditivo alimentar, a Agência Nacional de Vigilância Sanitária (ANVISA) define seu limite máximo de 30 mg por 100 gramas de amostra e um IDA (Ingestão Diária Aceitável) de 7,5 mg/Kg de peso corpóreo para tartrazina.