Questões de Vestibular
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 448 questões
Pressão Osmótica é a pressão que deve ser aplicada à solução para evitar que ocorra o fluxo osmótico, ou seja, a passagem de solvente do meio mais diluído para o meio mais concentrado através de uma membrana semipermeável. O sangue e o soro fisiológico (0,9% em massa de NaCl) apresentam a mesma pressão osmótica. Uma célula de hemoglobina foi colocada em uma solução 0,20 mol/L de NaCl.
Fonte: Adaptado de: https://mundoeducacao.bol.uol.com.br/quimica/pressao-osmotica.htm – Acesso em 14 de Maio de 2019.
Em relação à solução, essa célula estará em meio:
Dados: Massas molares em g . mol−1 : H = 1; C = 12; N = 14; O = 16.
Fórmula molecular da creatinina: C4H7N3O
Entre as razões elencadas para a baixa procura pelo novo diesel, a mais citada é o prazo dado aos fabricantes de veículos pesados para entregar, até março, os veículos vendidos e faturados em 2011, cujos motores podem funcionar com qualquer dos três tipos de óleo diesel à disposição no país. Como o diesel S50 é o tipo mais caro ainda não consegue estimular a adesão dos consumidores, mesmo sendo menos poluente.
http://www.automotivebusiness.com.br/noticia_det.aspx?id_noticia=12912 em 26.01.2012
Suponha que em um posto de combustíveis, o tanque de estocagem de óleo diesel S50 possua capacidade volumétrica de 30 m3 e esteja cheio desse combustível, cuja densidade é de 0,85 g/cm3. Sendo assim, é correto afirmar que a massa máxima de enxofre contida no combustível armazenado nesse tanque é de

A daminozida, também conhecida como Alar, é um regulador do crescimento de plantas, usado na pulverização de frutas, como
maçãs, para tornar mais fácil a colheita e evitar a queda das frutas antes do amadurecimento. O Alar garante a cor vermelha
e a firmeza da fruta para embalagem. A Agência de Proteção Ambiental dos Estados Unidos proibiu, em 1989, o uso da substância
química para consumo humano, em razão de apresentar alto risco carcinogênico. O produto da degradação da daminozida, a
dimetil-hidrazina assimétrica, UDMH, usada em combustíveis para foguetes espaciais e mísseis, é também carcinogênico.
Normalmente, os riscos e a quantidade de aditivo de alimentos consumidos na ingestão de maçãs não são informados pelos
produtores e distribuidores de frutas.
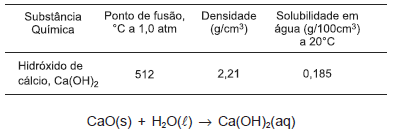
O hidróxido de cálcio, conhecido como cal hidratada ou extinta, é um sólido branco pouco solúvel em água, utilizado na preparação de argamassa e na pintura de paredes. No tratamento de água e de esgotos, participa como regulador de pH e floculante.
Considerando-se as informações da tabela, da equação química e do texto, é correto afirmar:
• Na2 SO4 0,10 mol/L • C6 H12O6 0,30 mol/L • KCl 0,15 mol/L
Comparando essas três soluções, pode-se afirmar que elas têm a mesma
Dados: Massas atômicas (g/mol): Enxofre = 32,06; Cálcio = 40,08; Oxigênio = 16,00
Considerando os dados apresentados, qual é a massa de óxido de cálcio (em gramas) necessária para o preparo de 50 litros da solução que será usada no pomar de peras?
H2SO4 + 2NaHCO3 → Na2SO4 + 2H2O + 2CO2
A massa de bicarbonato de sódio necessária para a neutralização completa do ácido sulfúrico contido nessa solução é igual a

Sobre o clorato de potássio e suas propriedades NÃO é correto afirmar que
Assinale a alternativa correta.
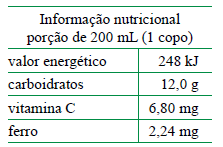
Dada a constante de Avogadro, 6,0 × 1023 mol–1 , é correto afirmar que 1 litro desse suco contém um número total de espécies de ferro, massa molar 56 g·mol–1 , igual a
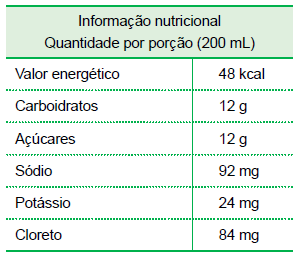
Considerando uma porção de isotônico, assinale a alternativa que apresenta as espécies químicas sódio, potássio e cloreto em ordem crescente de concentração expressa em mol/L.
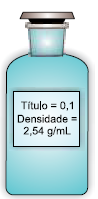
Considerando a massa molar desse composto igual a 106 g/mol, a concentração aproximada, em g/L e em mol/L, de Na2CO3 nessa solução é, respectivamente,
