Questões de Vestibular
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 436 questões
Vinagre é uma mistura homogênea cujo principal constituinte é o ácido acético. Um estudante de química analisou uma amostra de uma garrafa de 500mL de vinagre de maçã, em que, no rótulo, há a informação de que o teor do ácido acético presente na solução é de 4,2% m/v.
Considerando que o ácido acético é o único composto de caráter ácido do vinagre, analise as proposições sugeridas pelo estudante após as análises.
I- A molaridade do ácido acético na amostra analisada é 0,7mol/L.
II- Ao titular 20mL desse vinagre com hidróxido de sódio 1mol/L, foram gastos 50mL da base.
III- Uma cozinheira que utiliza 6,3g de vinagre por dia, durante 30 dias, irá utilizar 9 garrafas.
Está(ão) CORRETA(S) a(s) afirmativa(s):
Dados: Massas molares em g.mol−1 : Au = 197; Br = 80.
1) Ao adicionar mais íons Na+ em solução, ocorrerá a precipitação do NaCl. 2) Com a adição de água na solução, a mesma manterá sua saturação. 3) O aumento na concentração de íons Na+ provoca um aumento no kps do NaCl.
Está(ão) correta(s) a(s) afirmativa(s):

(https://planetatirinha.wordpress.com)
Considerando que a concentração expressa na tirinha seja uma relação em volume e que a densidade do álcool seja igual a 0,8 g/mL, uma dose de 100 mL de rum deverá conter uma quantidade de álcool igual a
DADOS QUE PODEM SER USADOS NESTA QUESTÃO

DADOS QUE PODEM SER USADOS NESTA QUESTÃO

Massas molares, em g/mol: H = 1, O = 16, Cl = 35,5
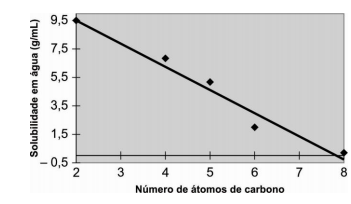
O gráfico a seguir mostra a relação entre o número de átomos de carbono e a solubilidade em água de uma série de ácidos dicarboxílicos.
Disponível em:
<http://www.profpc.com.br/Qu%C3%ADmica%20na%20Cozinha/
Qu%C3%ADmica%20dos%20Sentidos/Qu%C3%ADmica_sentidos.htm#PO
NTO_DE_FUS%C3%83O_E_PONTO_DE_EBULI%C3%87% C3%83º>.
Acesso em: 9 ago. 2018.
De acordo com esse gráfico, a solubilidade em água do
ácido succínico é aproximadamente 6,8 g/mL. A fórmula
química desse ácido é
O soro de reidratação caseiro, que tem salvado muitas vidas,é preparado dissolvendo-se uma colher de sopa de sacarose,C12H22O11, e uma colher de chá de sal de cozinha em um copo de água de 250ml.
Em relação ao soro de reidratação e seus componentes, é correto afirmar:
“Os íons de metais alcalinos têm importantes funções no nosso organismo, tais como influenciar em contrações musculares e pressão arterial, manter a pressão osmótica dentro das células e influenciar a condução dos impulsos nervosos. A diferença nas concentrações totais de íon de metais alcalinos dentro e fora da célula produz um potencial elétrico pela membrana celular, responsável, por exemplo, pela geração de sinais elétricos rítmicos no coração. As concentrações de Na+ e K+ nas células sanguíneas vermelhas são de 0,253 g.L−1 e de 3,588 g.L−1, respectivamente”.
Rayner-Canham, G.; Overton, T.
Química Inorgânica Descritiva. LTC.
As concentrações aproximadas desses íons, em
mol L−1, são respectivamente
Dados: Massas atômicas (g/mol): Enxofre = 32,06; Cálcio = 40,08; Oxigênio = 16,00
Considerando os dados apresentados, qual é a massa de óxido de cálcio (em gramas) necessária para o preparo de 50 litros da solução que será usada no pomar de peras?
Considere as informações:
• No estado de Sergipe, encontram-se as maiores reservas brasileiras de minerais de potássio, constituídas principalmente por silvinita, composta pela associação dos minerais halita (NaCl) e silvita (KCl). O teor médio de íons potássio na silvinita é cerca de 8% em massa.
• Na água do mar, a concentração média de íons potássio é cerca de 0,4 g/L.
O volume de água do mar que contém a mesma massa de íons potássio existente em cada tonelada de silvinita é
2FeS2 + 7O2 + 2H2O → 2FeSO4 + 2H2SO4
Em uma amostra de água retirada de um rio, foi encontrada uma concentração de FeSO4 igual a 0,02 mol/L. Nesse rio, a massa de FeS2 dissolvida por litro de água era igual a
Considerando-se as informações do texto associadas aos conhecimentos sobre soluções aquosas, é correto afirmar:
Dados: massa atômica do ferro = 56 g.mol-1.
