Questões de Vestibular
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 996 questões
Com a crescente crise mundial de dengue, as pesquisas pela busca tanto de vacinas quanto de repelentes de insetos têm se intensificado. Nesse contexto, os compostos I e II abaixo representados têm propriedades muito distintas: enquanto um deles tem caráter ácido e atrai os insetos, o outro tem caráter básico e não os atrai.
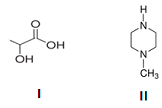
Baseado nessas informações, pode-se afirmar
corretamente que o composto
As tabelas I, II e III mostram os valores limites para o veículo em questão e os valores medidos.

Analisando-se esses dados, conclui-se que o veículo submetido à inspeção deve ter sido
Massas molares em g/mol
Ti = 48
O = 16
Quando borbulhado em água, o H2S comporta-se como ácido fraco, estabelecendo-se os equilíbrios simultâneos representados pelas equações a seguir:
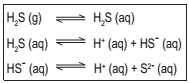
Dentre os procedimentos a seguir, o único que provoca um aumento do escape de sulfeto de hidrogênio de uma solução aquosa para o ar é
I O cloreto de cálcio é um sólido iônico.
II O cloreto de cálcio sólido é um bom condutor de eletricidade.
III Para ser usado como “secante de armário", o sal deve ser higroscópico.
São verdadeiras:
O sal formado entre o ácido bórico e o hidróxido de magnésio apresenta a seguinte composição centesimal:
O Nobel da Paz de 2013 foi entregue à Organização para a Proibição das Armas Químicas, o que reforçou a preocupação mundial quanto à erradicação desse tipo de armamento. O VX é um agente químico altamente tóxico, classificado como arma de destruição em massa. A eliminação desse agente é realizada via degradação, que pode ocorrer por três caminhos, tal como ilustrado. No entanto, o composto “5" também pode atuar como arma química, por ser muito mais tóxico que os outros produtos da degradação.
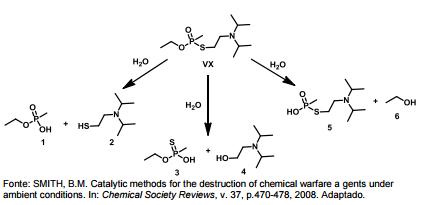
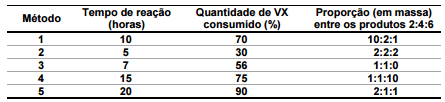
(Dados: Kf = 1,86 ºC.kg.mol-1; M(g.mol-1): Cl = 35,5; Na = 23)
A diferença na temperatura de fusão (em °C) na mistura obtida ao se dissolver 200 g de sal de cozinha em 1 kg de água, em relação à água pura, é de:
O fenol é um composto químico altamente tóxico encontrado em efluentes (resíduos aquosos de processos químicos) de variadas indústrias como a farmacêutica, de tintas e de papel e celulose.
O fenol se ioniza em água de acordo com o equilíbrio

A concentração máxima permitida para fenóis em águas
não cloradas é de 0,1 mg/L. Contudo, em águas cloradas, a
concentração máxima permitida para fenóis pela resolução
n° 357 do CONAMA é de 0,003 mg/L.
Os químicos do laboratório de análises de uma indústria de tintas prepararam cinco amostras, cada uma com 1000 mL de efluente do processo, contendo fenol. A quatro delas, adicionaram – a cada uma separadamente – 0,1 mol das seguintes substâncias: KBr, NaCl, NaOH, HCl. A quinta amostra foi mantida apenas com o efluente. Após esse procedimento, fizeram análises da concentração de fenolato, C6 H5 O– , por instrumento de medida, em cada uma das cinco amostras.
Ao final dessa pesquisa, os químicos concluíram corretamente que a amostra que apresentou maior concentração de íon fenolato, dentre as cinco, foi aquela contendo
O fenol é um composto químico altamente tóxico encontrado em efluentes (resíduos aquosos de processos químicos) de variadas indústrias como a farmacêutica, de tintas e de papel e celulose.
O fenol se ioniza em água de acordo com o equilíbrio

A concentração máxima permitida para fenóis em águas
não cloradas é de 0,1 mg/L. Contudo, em águas cloradas, a
concentração máxima permitida para fenóis pela resolução
n° 357 do CONAMA é de 0,003 mg/L.
TEXTO 7
Memórias de um pesquisador
Não era bem vida, era uma modorra – mas de qualquer modo suportável e até agradável. Terminou bruscamente, porém, eu estando com vinte e oito anos e um pequeno bujão de gás explodindo mesmo à minha frente, no laboratório de eletrônica em que trabalhava, como auxiliar. Me levaram às pressas para o hospital, os médicos duvidando que eu escapasse. Escapei, mas não sem danos. Perdi todos os dedos da mão esquerda e três (sobraram o polegar e o mínimo) da direita. Além disso fiquei com o rosto seriamente queimado. Eu já não era bonito antes, mas o resultado final – mesmo depois das operações plásticas – não era agradável de se olhar. Deus, não era nada agradável.
No entanto, nos primeiros meses após o acidente eu não via motivos para estar triste. Aposentei-me com um bom salário. Minha velha tia, com quem eu morava, desvelava-se em cuidados. Preparava os pastéis de que eu mais gostava, cortava-os em pedacinhos que introduzia em minha boca – derramando sentidas lágrimas cuja razão, francamente, eu não percebia. Deves chorar por meu pai – eu dizia – que está morto, por minha mãe que está morta, por meu irmão mais velho que está morto; mas choras por mim. Por quê? Escapei com vida de uma explosão que teria liquidado qualquer um; não preciso mais trabalhar; cuidas de mim com desvelo; de que devo me queixar?
Cedo descobri. Ao visitar certa modista.
Esta senhora, uma viúva recatada mas ardente, me recebia todos os sábados, dia em que os filhos estavam fora. Quando me senti suficientemente forte telefonei explicando minha prolongada ausência e marcamos um encontro.
Ao me ver ficou, como era de se esperar, consternada. Vais te acostumar, eu disse, e propus irmos para a cama. Me amava, e concordou. Logo me deparei com uma dificuldade: o coto (assim eu chamava o que tinha me sobrado da mão esquerda) e a pinça (os dois dedos restantes da direita) não me forneciam o necessário apoio. O coto, particularmente, tinha uma certa tendência a resvalar pelo corpo coberto de suor da pobre mulher. Seus olhos se arregalavam; quanto mais apavorada ficava, mais suava e mais o coto escorregava.
Sou engenhoso. Trabalhando com técnicos e cientistas aprendi muita coisa, de modo que logo resolvi o problema: com uma tesoura, fiz duas incisões no colchão. Ali ancorei coto e pinça. Pude assim amá-la, e bem.
– Não aguentava mais – confessei, depois. – Seis meses no seco!
Não me respondeu. Chorava. – Vais me perdoar, Armando – disse – eu gosto de ti, eu te amo, mas não suporto te ver assim. Peço-te, amor, que não me procures mais.
– E quem vai me atender daqui por diante? – perguntei, ultrajado.
Mas ela já estava chorando de novo. Levantei-me e saí. Não foi nessa ocasião, contudo, que fiquei deprimido. Foi mais tarde; exatamente uma semana depois.
[...]
(SCLIAR, Moacyr. Melhores contos. Seleção de
Regina Zilbermann. São Paulo: Global, 2003. p.
176-177.)
A pólvora, usada como explosivo desde tempos remotos, é uma mistura de nitrato de potássio, enxofre e carvão. Com a explosão, ocorre formação de sulfato de potássio, dióxido de carbono e nitrogênio molecular.
Sobre essa explicação acerca da explosão, assinale a única afirmação correta:
A ionização do ácido cianídrico é representada pela equação química abaixo:
HCN (aq)  H+ (aq) + CN–
(aq)
H+ (aq) + CN–
(aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo
grau de ionização α
constante de equilíbrio Ka
potencial hidrogeniônico pH
concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte
símbolo:
Dados: Ka (CH3COOH) = 1,8 x 10-5 (250C), log 2 = 0,30 e log 3 = 0,47.