Questões de Vestibular
Sobre teoria atômica: modelo atômico de dalton, thomson, rutherford, rutherford-bohr em química
Foram encontradas 125 questões
Com relação a princípios da química, julgue o próximo item.
Os diversos estados energéticos dos elétrons são denominados camadas ou níveis de energia, tanto no modelo atômico de Thomson quanto no modelo atômico de Bohr.
Observação: elétron emparelhado.
O número atômico do átomo citado é:
Dados: vanádio Z = 23.
I - O modelo atômico de Dalton foi capaz de explicar fenômenos acerca da natureza elétrica da matéria, como a eletrização por atrito e as descargas elétricas em gases. II - Ao fazer incidir partículas radioativas em uma lâmina metálica de ouro, Rutherford observou que um grande número dessas partículas atravessava a lâmina sem sofrer desvio, algumas desviavam; e poucas eram refletidas. Dessa forma, ele propôs que o átomo possui um núcleo muito pequeno, em comparação com a sua eletrosfera. III - O estudo das linhas espectrais dos átomos foi essencial para a proposição do conceito de energia quantizada.
Dado: número atômico do K = 19.
I - Partículas alfa, ao bombardearem uma fina folha de ouro, são desviadas de seu trajeto. Tudo leva a crer que os átomos presentes no metal possuem um núcleo denso e de carga positiva. II - Os átomos de determinado elemento químico são indivisíveis e idênticos em todas as suas propriedades. Átomos de elementos diferentes apresentam massas diferentes. III - Os elétrons presentes em um átomo movem-se em órbitas, em torno do núcleo, sem perder ou ganhar energia. Essas órbitas são denominadas camadas.
Essas proposições são atribuídas, respectivamente, ao cientistas:
Observe a representação abaixo:
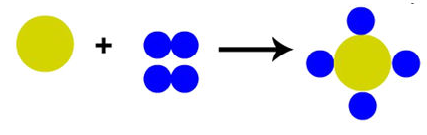
Disponível em: <https://m.brasilescola.uol.com.br. Acesso em: 20 out. 2018.
Baseada na teoria atômica de Dalton, ela contribui para a compreensão
n= 3 l= 2 m= 0 s= -1/2
É CORRETO afirmar que o elemento usado na produção das baterias e que possui essa localização do elétron no átomo só poderia ser:
As figuras representam dois modelos, 1 e 2, para o átomo de hidrogênio. No modelo 1, o elétron move-se em trajetória espiral, aproximando-se do núcleo atômico e emitindo energia continuamente, com frequência cada vez maior, uma vez que cargas elétricas aceleradas irradiam energia. Esse processo só termina quando o elétron se choca com o núcleo. No modelo 2, o elétron move-se inicialmente em determinada órbita circular estável e em movimento uniforme em relação ao núcleo, sem emitir radiação eletromagnética, apesar de apresentar aceleração centrípeta. Nesse modelo a emissão só ocorre, de forma descontínua, quando o elétron sofre transição de uma órbita mais distante do núcleo para outra mais próxima.
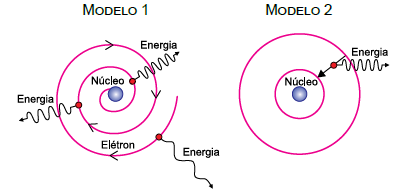
A respeito desses modelos atômicos, pode-se afirmar que
Considere as seguintes afirmações a respeito do experimento de Rutherford e do modelo atômico de Rutherford-Bohr.
I - A maior parte do volume do átomo é constituída pelo núcleo denso e positivo.
II - Os elétrons movimentam-se em órbitas estacionárias ao redor do núcleo.
III- O elétron, ao pular de uma órbita mais externa para uma mais interna, emite uma quantidade de energia bem definida.
Quais estão corretas?

