Questões de Vestibular
Sobre teoria atômica: modelo atômico de dalton, thomson, rutherford, rutherford-bohr em química
Foram encontradas 125 questões
Quando uma pequena quantidade de cloreto de sódio é colocada na ponta de um fio de platina e levada à chama de um bico de Bunsen, a observação macroscópica que se faz é que a chama inicialmente azul adquire uma coloração laranja. Outros elementos metálicos ou seus sais produzem uma coloração característica ao serem submetidos à chama, como exemplo: potássio (violeta), cálcio (vermelho-tijolo), estrôncio (vermelho-carmim) e bário (verde). O procedimento descrito é conhecido como teste de chama, que é uma técnica utilizada para a identificação de certos átomos ou cátions presentes em substâncias ou misturas.
Sobre o assunto acima e com base na Teoria Atômica, é CORRETO afirmar que:
as cores observadas podem ser explicadas considerando-se o modelo atômico proposto por
Bohr.
Quando uma pequena quantidade de cloreto de sódio é colocada na ponta de um fio de platina e levada à chama de um bico de Bunsen, a observação macroscópica que se faz é que a chama inicialmente azul adquire uma coloração laranja. Outros elementos metálicos ou seus sais produzem uma coloração característica ao serem submetidos à chama, como exemplo: potássio (violeta), cálcio (vermelho-tijolo), estrôncio (vermelho-carmim) e bário (verde). O procedimento descrito é conhecido como teste de chama, que é uma técnica utilizada para a identificação de certos átomos ou cátions presentes em substâncias ou misturas.
Sobre o assunto acima e com base na Teoria Atômica, é CORRETO afirmar que:
no teste de chama as cores observadas são decorrentes da excitação de elétrons para níveis
de energia mais externos provocada pela chama e, quando estes elétrons retornam aos seus
níveis de origem, liberam energia luminosa, no caso, na região da luz visível.
Quando uma pequena quantidade de cloreto de sódio é colocada na ponta de um fio de platina e levada à chama de um bico de Bunsen, a observação macroscópica que se faz é que a chama inicialmente azul adquire uma coloração laranja. Outros elementos metálicos ou seus sais produzem uma coloração característica ao serem submetidos à chama, como exemplo: potássio (violeta), cálcio (vermelho-tijolo), estrôncio (vermelho-carmim) e bário (verde). O procedimento descrito é conhecido como teste de chama, que é uma técnica utilizada para a identificação de certos átomos ou cátions presentes em substâncias ou misturas.
Sobre o assunto acima e com base na Teoria Atômica, é CORRETO afirmar que:
a cor da luz emitida depende da diferença de energia entre os níveis envolvidos na transição
das partículas nucleares e, como essa diferença varia de elemento para elemento, a luz
apresentará uma cor característica para cada elemento.
Quando uma pequena quantidade de cloreto de sódio é colocada na ponta de um fio de platina e levada à chama de um bico de Bunsen, a observação macroscópica que se faz é que a chama inicialmente azul adquire uma coloração laranja. Outros elementos metálicos ou seus sais produzem uma coloração característica ao serem submetidos à chama, como exemplo: potássio (violeta), cálcio (vermelho-tijolo), estrôncio (vermelho-carmim) e bário (verde). O procedimento descrito é conhecido como teste de chama, que é uma técnica utilizada para a identificação de certos átomos ou cátions presentes em substâncias ou misturas.
Sobre o assunto acima e com base na Teoria Atômica, é CORRETO afirmar que:
as cores observadas na queima de fogos de artifícios e da luz emitida pelas lâmpadas de
vapor de sódio ou de mercúrio não são decorrentes de processos eletrônicos idênticos aos
observados no teste de chama.
Quando uma pequena quantidade de cloreto de sódio é colocada na ponta de um fio de platina e levada à chama de um bico de Bunsen, a observação macroscópica que se faz é que a chama inicialmente azul adquire uma coloração laranja. Outros elementos metálicos ou seus sais produzem uma coloração característica ao serem submetidos à chama, como exemplo: potássio (violeta), cálcio (vermelho-tijolo), estrôncio (vermelho-carmim) e bário (verde). O procedimento descrito é conhecido como teste de chama, que é uma técnica utilizada para a identificação de certos átomos ou cátions presentes em substâncias ou misturas.
Sobre o assunto acima e com base na Teoria Atômica, é CORRETO afirmar que:
as cores observadas para diferentes átomos no teste de chama podem ser explicadas pelos
modelos atômicos de Thomson e de Rutherford.
Em 1911, o renomado cientista Ernest Rutherford e seus colaboradores Marsden e Geiger realizaram uma série de experimentos com materiais que emitiam partículas alfa (α). Os resultados obtidos levaram esse pesquisador a sugerir um novo modelo para o átomo. A figura a seguir representa, esquematicamente, um desses experimentos.
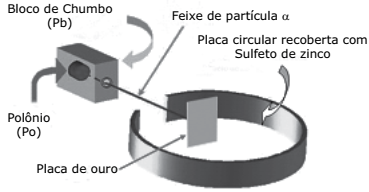
Sobre os motivos que levaram Rutherford a realizar esses experimentos e as conclusões que ele obteve, foram feitas as afirmações:
I. Rutherford concordava com o modelo atômico sugerido por Thomson e, por isso, esperava que todas as partículas alfa(α) atravessassem a placa de ouro com facilidade.
II. O modelo atômico proposto por Rutherford sugere que o átomo é eletricamente neutro, apesar de ser constituído por partículas positivas e negativas.
III. Rutherford desenvolveu esses experimentos porque estudava o comportamento dos prótons e elétrons que constituem a placa de ouro.
Assinale a alternativa em que foram apontadas as afirmativas CORRETAS.
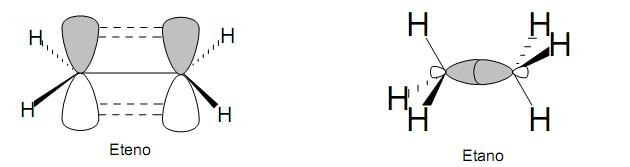
Na figura acima, temos os modelos simplificados da formação das ligações químicas de eteno e etano. De acordo com os orbitais explícitos nessas moléculas, é CORRETO afirmar que representam, respectivamente, ligações do tipo:
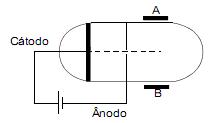
De acordo com esse esquema, o feixe se aproxima de A quando