Questões de Vestibular
Sobre teoria atômica: modelo atômico de dalton, thomson, rutherford, rutherford-bohr em química
Foram encontradas 125 questões
A aceitação histórica da ideia de que a matéria é composta de átomos foi lenta e gradual. Na Grécia antiga, Leucipo e Demócrito são lembrados por terem introduzido o conceito de átomo, mas suas propostas foram rejeitadas por outros flósofos e caíram no esquecimento. No fnal do século XVIII e início do século XIX, quando as ideias de Lavoisier ganhavam aceitação generalizada, surgiu a primeira teoria atômica moderna, proposta por _______. Essa teoria postulava que os elementos eram constituídos de um único tipo de átomo, enquanto que as substâncias compostas eram combinações de diferentes átomos segundo proporções determinadas. Quase cem anos depois, estudos com raios catódicos levaram J. J. Thomson à descoberta do _______, uma partícula de massa muito pequena e carga elétrica _______, presente em todos os materiais conhecidos. Alguns anos depois, por meio de experimentos em que uma fna folha de ouro foi bombardeada com partículas alfa, Rutherford chegou à conclusão de que o átomo possui em seu centro um _______ pequeno, porém de massa considerável.
As palavras que preenchem as lacunas correta e respectivamente estão reunidas em
Na época de Dalton, acreditava-se que, em massa, a água tinha 1/8 de hidrogênio, e que a amônia tinha 1/6 de hidrogênio. Com isso, foi possível concluir que as massas atômicas do oxigênio e do nitrogênio valiam, respectivamente,

A figura I, acima, apresenta gráficos representativos da
absortividade de alguns gases da atmosfera e da atmosfera como um
todo, enquanto a figura II representa o espectro na faixa de luz
visível. Tendo como base essas figuras e considerando o número de
Avogadro igual a 6 × 1023 e a velocidade da luz igual a 3 × 108 m/s,
julgue os próximos itens.

As observações de Rutherford citadas no texto foram possíveis após a experiência de espalhamento de partículas alfa em uma fna lâmina de ouro.
Assinale, abaixo, a afrmativa que NÃO faz parte dessas observações experimentais de Rutherford:
De acordo com o modelo de Thomson, o hidrogênio é constituído por 1 próton, 1 elétron e 1 nêutron.
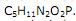 O sarin, quando em contato com a pele ou inalado, gera contrações musculares, convulsões, estado de coma e paralisia do sistema respiratório, provocando a morte lenta da pessoa.
O sarin, quando em contato com a pele ou inalado, gera contrações musculares, convulsões, estado de coma e paralisia do sistema respiratório, provocando a morte lenta da pessoa. Sobre alguns dos elementos que constituem o sarin e que formam também substâncias essenciais à manutenção da vida, assinale a afirmação FALSA.
Sobre a descoberta e as características das partículas elementares dos átomos, é correto afirmar-se que
Há dois tipos de cargas elétricas: positivas e negativas. As cargas de nomes iguais (mesmo sinal) se repelem e as de nomes distintos (sinais diferentes) se atraem. De acordo com a informação, assinale a alternativa correta.
Considerando-se essas informações acerca desses modelos atômicos, é correto afirmar:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Ernest Rutherford, em seu modelo atômico, descrevia o átomo como uma estrutura na qual a carga positiva permanecia no centro, constituindo o núcleo, enquanto as cargas negativas giravam em torno desse núcleo.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Joseph J. Thomson, em seu modelo atômico, descrevia o átomo como uma massa de carga positiva que contém elétrons de carga negativa incrustados no seu interior que neutralizavam a massa positiva.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
De acordo com o modelo atômico de Dalton, o elétron é uma partícula maciça e indivisível.
