Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.209 questões
Na época de Dalton, acreditava-se que, em massa, a água tinha 1/8 de hidrogênio, e que a amônia tinha 1/6 de hidrogênio. Com isso, foi possível concluir que as massas atômicas do oxigênio e do nitrogênio valiam, respectivamente,

As afirmativas 1, 2, 3, e 4 referem-se, respectivamente, às espécies químicas
Logo, as cargas elétricas relativas do alumínio nas latinhas e na pedra-ume são, respectivamente,
Supondo rendimento de 100%, a massa, em gramas, de cloreto de cálcio que deve reagir para produzir 10 g de carbonato de cálcio é, aproximadamente,
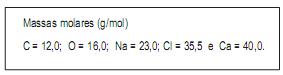
• mudança de cor;
• mudança de cheiro e
• produção de gás.
Essas três vidências são observadas, conjuntamente, quando
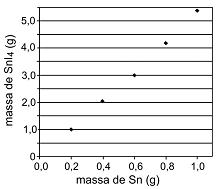
Com base nesses resultados experimentais, é possível afirmar que o valor da relação
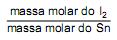
é, aproximadamente,
Qual é o grau de pureza da amostra?
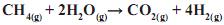
Em relação a este processo, é CORRETO afrmar que, ao reagir

As observações de Rutherford citadas no texto foram possíveis após a experiência de espalhamento de partículas alfa em uma fna lâmina de ouro.
Assinale, abaixo, a afrmativa que NÃO faz parte dessas observações experimentais de Rutherford:
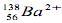

Desta forma, assinale abaixo a alternativa correta.
I) X H2 + O2 → H2O
II) Ca(OH)2 + H3PO4 → H2O + A
III) Na + ZnCl2 → NaCl + Zn.
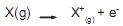
Esse é um processo endotérmico, porque o elétron é atraído pelo núcleo positivo, portanto, deve-se fornecer energia para removê-lo. Uma vez que todos os átomos, exceto o hidrogênio, possuem mais do que um elétron, eles também possuem mais de um potencial de ionização. Considerando essa informação, escolha a alternativa que apresenta o átomo com maior potencial de ionização dentre os pares abaixo:
(1) B ou C; (2) O ou Si; (3) Cl ou As.
 Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é
Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é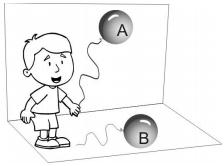
Sabendo-se que o volume molar de um gás ao nível do mar a 25º C é 25 L mol -1 e a densidade do ar atmosférico é 1,2 g L-1 .
Quais são os gases que as bexigas A e B podem conter, respectivamente:
