Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.192 questões
A cal, muito utilizada na construção civil, é obtida na indústria a partir da reação de decomposição do calcário, representada pela equação:
CaCO3(s)  CaO(s) + CO2(g)
CaO(s) + CO2(g)
A fonte de calor para essa decomposição pode ser o gás natural,cuja reação de combustão é representada por:
CH4(g) + 2O2(g) → 2H2O(l) + CO2(g)
Considerando as massas molares:
H = 1,0 g·mol–1 , C = 12,0 g·mol–1 ,
O = 16,0 g·mol–1 , Ca = 40,0 g·mol–1 ,
a massa de gás carbônico lançada na atmosfera quando são produzidos
560 kg de cal, a partir da decomposição térmica do calcário,
utilizando o gás natural como fonte de energia, é:
I. Gases são facilmente compressíveis, preenchem o espaço disponível e suas moléculas possuem movimento caótico incessante.
II. A energia cinética média das moléculas de um gás é diretamente proporcional à temperatura absoluta.
III. A pressão de um gás é o resultado das colisões das moléculas com as paredes do recipiente.
IV. As moléculas se movimentam sem colidirem com as paredes do recipiente que as contém.
Assinale a alternativa que apresenta informações corretas.
Na0 + H2O
 NaOH + 1/2 H2
NaOH + 1/2 H2Assinale a alternativa que apresenta a classe de reação na qual se enquadra essa transformação.
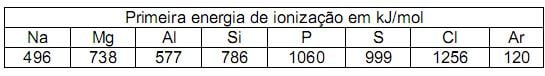
No entanto, apresenta duas exceções: o Alumínio e o Enxofre. A diminuição da energia de ionização do fósforo para o enxofre pode ser explicada pelo fato de
H2 SO4(aq) + 2NaOH(aq) → Na2 SO4(aq) + 2H2 O(I)
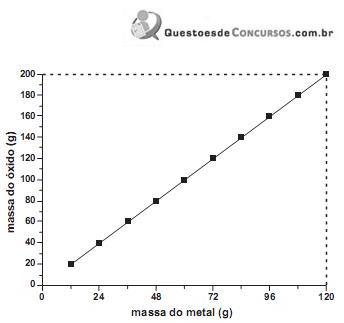
Durante um experimento, realizado em recipiente fechado, foi colocado para reagir 1,00 g do referido metal, obtendo-se 1,40 g do seu óxido. Considerando-se que todo o oxigênio presente no frasco foi consumido, pode-se determinar que a massa de oxigênio presente no sistema inicial é x . Em outro recipiente fechado, foram colocados 1,50 g do referido metal em contato com 1,20 g de oxigênio. Considerando que a reação ocorreu até o consumo total de pelo menos um dos reagentes, pode- se afirmar que amassa de óxido gerado é y . Sabendo que ometal emquestão forma apenas um cátion estável e considerando que em todas as reações o rendimento foi de 100 %, os valores de x e y são, respectivamente,
Um técnico de laboratório distraído preparou solições de carbonato de potássio (K2CO3),
hidróxido de sódio (NaOH) e de hidróxido de cálcio (Ca(OH)2), colocando- se em três frascos não rotulados ( frascos X, Y E Z ).
Para identificar as soluções, um aluno misturou, em três tubos de ensaio distintos,
amostras de cada frasco com solução aquosa de ácido clorídrico. Nada foi observado nas soluções dos frascos X e Z, mas ocorreu uma efervenscência no
tuboque continha a solução do frasco Y.
Em seguida, o aluno combinou, dois a dois, os conteúdos de cada frasco ( frasco X, Y e Z ) em tubos de ensaios limpos.
Observou que só houve formação de precipitado quando misturou as soluções dos frascos X e Y.
Assinale a alternativa que identifica corretamente o conteúdo dos frascos X, Y e Z.
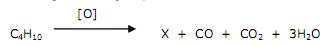
Daí pode-se afirmar que o composto X é um(a)
A ligação peptídica em um peptídio é:
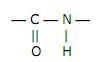
Com relação a ligação peptídica assinale a afirmação verdadeira.
NaCl + MnO2 + H2SO4 → Na2SO4 + Cl2 + H2O
Sabendo que a mesma teve um rendimento de 80% e foi realizada a uma temperatura de 27 °C e a uma pressão de 1 atm e que utilizou 600 g de NaCl, o volume de Cl2 obtido, em litros, foi, aproximadamente,
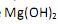 mediante a sua reação com CaO, como descrito na reação abaixo:
mediante a sua reação com CaO, como descrito na reação abaixo: 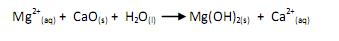
A massa de CaO necessária para precipitar 783 g de Mg(OH)2 é:
I. O tamanho do raio atômico dos elementos químicos cresce da direita para a esquerda nos periódicos e cresce de cima para baixo nos grupos.
II. O tamanho do raio atômico dos elementos químicos cresce da esquerda para direita nos periódicos, assim como a eletropositividade.
III. O iodo apresenta raio atômico menor do que o cloro.
IV. O nitrogênio apresenta raio atômico maior do que o flúor.
Analise a alternativa correta.
Na – 1s 2 2s 2 2p6 3s 1
Fe – 1s 2 2s 2 2p6 3s 2 3p6 4s 2 3d6
P – 1s 2 2s 2 2p6 3s 2 3p3
A partir das distribuições eletrônicas acima, assinale a alternativa incorreta.