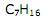Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.180 questões
Considere que o volume residual de ar nos pulmões após uma expiração seja de 1,5 L. Nesse caso, se, em uma aspiração típica, forem absorvidos 0,5 L de ar e os pulmões permanecerem à temperatura constante, então a pressão exercida pelo ar após uma aspiração será equivalente a 75% da pressão nos pulmões com volume residual.
Os compostos orgânicos gerados pela oxidação branda das duplas do ácido araquidônico usando-se uma solução aquosa diluída e neutra de KMnO4 — reação de Bayer — apresentam maior solubilidade em água que o ácido araquidônico.
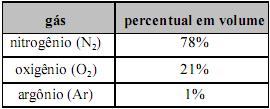
Considere que o ar atmosférico seja uma mistura de gases e tenha a composição mostrada na tabela abaixo. Sabendo-se que a massa molar aparente desse ar é a média ponderada que relaciona a fração em volume de cada componente com a sua respectiva massa molar e assumindo-se a constante universal dos gases R = 0,082 atm·L/KAmol, é correto afirmar que, a 1 atm e a 0 ºC, a densidade aparente desse ar é superior a 1,25 g/L.
Presente na hemoglobina, o íon divalente do ferro tem seu raio iônico maior que o raio do átomo do ferro metálico e apresenta distribuição eletrônica 1s2 2s2 2p6 3s2 3p6 4s2 3d8 .
Questão Discursiva
Em um frasco de 1,0 L, foram colocados, a determinada temperatura, 0,880 g de N2O e 1,760 g de O2 gasosos, para reagir. Após se estabelecer o equilíbrio químico, foi formado 1,012 g de gás NO2. Considerando essas condições, calcule a concentração molar de equilíbrio do O2 e multiplique o resultado por 104 . Para marcação no Caderno de Respostas, despreze, caso exista, a parte fracionária do resultado obtido, após ter efetuado todos os cálculos solicitados.
R:385
Se o fluxo de prótons por segundo nas imediações da Terra for de 7 prótons por centímetro quadrado na direção radial ao Sol, então o Sol estará emitindo mais de 1030 prótons por segundo.
De acordo com o modelo de Thomson, o hidrogênio é constituído por 1 próton, 1 elétron e 1 nêutron.
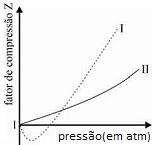
Considere que os gases da natureza, que são chamados de gases reais, tenham propriedades diferentes daquelas preditas pela lei dos gases ideais. Considere, ainda, o fator de compressão Z, que é a razão entre o volume molar do gás real e o volume molar de um gás ideal nas mesmas condições. Nesse caso, é correto afirmar que, no gráfico a seguir, da variação de Z em função da pressão, as curvas I e II representam, respectivamente, o comportamento dos gases NH3 e H2.
Sabe-se que o pH de alvejantes formados por soluções aquosas de hipoclorito de sódio é superior a 7. Isso se deve ao fato de o NaClO, ao reagir com a água, produzir o ácido hipocloroso (HClO), o que aumenta a razão [OH- ]/[H3O+ ] no meio.
O percentual em massa de nitrogênio presente em todo o explosivo usado para demolir a arquibancada do estádio Mané Garrincha foi de
Considerando-se o rendimento de 100% para a reação de combustão do nitrato de amônio, é correto afirmar que a quantidade de explosivo utilizada na referida demolição da arquibancada do estádio Mané Garrincha produziu mais de 9,0 × 105 kJ de energia.
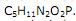 O sarin, quando em contato com a pele ou inalado, gera contrações musculares, convulsões, estado de coma e paralisia do sistema respiratório, provocando a morte lenta da pessoa.
O sarin, quando em contato com a pele ou inalado, gera contrações musculares, convulsões, estado de coma e paralisia do sistema respiratório, provocando a morte lenta da pessoa. Sobre alguns dos elementos que constituem o sarin e que formam também substâncias essenciais à manutenção da vida, assinale a afirmação FALSA.
Sobre a descoberta e as características das partículas elementares dos átomos, é correto afirmar-se que
Sobre os componentes do feijão, é correto afirmar- se que

A sequência correta, de cima para baixo, é:
I.
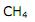
II.
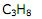
III.
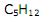
IV.