Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.209 questões
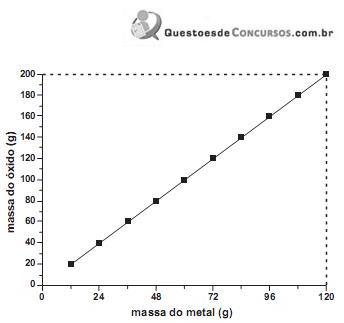
Durante um experimento, realizado em recipiente fechado, foi colocado para reagir 1,00 g do referido metal, obtendo-se 1,40 g do seu óxido. Considerando-se que todo o oxigênio presente no frasco foi consumido, pode-se determinar que a massa de oxigênio presente no sistema inicial é x . Em outro recipiente fechado, foram colocados 1,50 g do referido metal em contato com 1,20 g de oxigênio. Considerando que a reação ocorreu até o consumo total de pelo menos um dos reagentes, pode- se afirmar que amassa de óxido gerado é y . Sabendo que ometal emquestão forma apenas um cátion estável e considerando que em todas as reações o rendimento foi de 100 %, os valores de x e y são, respectivamente,
Um técnico de laboratório distraído preparou solições de carbonato de potássio (K2CO3),
hidróxido de sódio (NaOH) e de hidróxido de cálcio (Ca(OH)2), colocando- se em três frascos não rotulados ( frascos X, Y E Z ).
Para identificar as soluções, um aluno misturou, em três tubos de ensaio distintos,
amostras de cada frasco com solução aquosa de ácido clorídrico. Nada foi observado nas soluções dos frascos X e Z, mas ocorreu uma efervenscência no
tuboque continha a solução do frasco Y.
Em seguida, o aluno combinou, dois a dois, os conteúdos de cada frasco ( frasco X, Y e Z ) em tubos de ensaios limpos.
Observou que só houve formação de precipitado quando misturou as soluções dos frascos X e Y.
Assinale a alternativa que identifica corretamente o conteúdo dos frascos X, Y e Z.
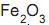 e impurezas. Ao se misturar 4,0 g de uma amostra deste minério com ácido clorídrico concentrado, obtêm- se 6,5 g de cloreto de ferro III. A porcentagem em massa de
e impurezas. Ao se misturar 4,0 g de uma amostra deste minério com ácido clorídrico concentrado, obtêm- se 6,5 g de cloreto de ferro III. A porcentagem em massa de 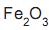 no minério é igual a
no minério é igual a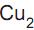 e CuO) se forma na superfície dos tachos, podendo se desprender e ser incorporado ao doce.
e CuO) se forma na superfície dos tachos, podendo se desprender e ser incorporado ao doce. Sobre o cobre e seus óxidos, é CORRETO afirmar que:
I – HCl(g) + NH 3(g) → NH4 Cl(s) (ácido clorídrico no estado gasoso reage com amônia no estado gasoso dando origem a cloreto de amônio no estado sólido).
II –CO2(g) + H2O(l) → H2 CO3(aq) (dióxido de carbono no estado gasoso reage com a água no estado líquido e dá origem a ácido carbônico em meio aquoso).
III – AgNO3(aq) + KI(aq) → Agl(s) + KNO3(aq) (solução aquosa de nitrato de prata reage com solução aquosa de iodeto de potássio formando iodeto de prata no estado sólido e nitrato de potássio insolúvel em água).
É correto APENAS o que se afirma em:
Se a massa de CO2 produzida foi 13,9 g, a quantidade em mol de CO é:
B2O3 + 3Mg → 2B + 3MgO
Partindo-se de 262,5 g do óxido de boro em excesso de magnésio, obteve- se 33 g de B, o que significa que o rendimento percentual (%) da reação foi mais próximo de:
Sobre as características desse elemento e suas propriedades, em função da sua posição na tabela periódica, é correto afirmar que o iodo
O símbolo do elemento químico cuja massa é cerca de metade da massa desse bóson é:
A relação entre essas energias é dada por:
Esses metais são encontrados comumente na forma de óxidos, sendo o caráter iônico dos óxidos diretamente proporcional ao raio atômico do metal.
O metal terra rara componente do óxido de maior caráter iônico possui o seguinte símbolo:

Tendo como referência as informações acima, julgue os itens de 121 a 124 e faça o que se pede no item 125, que é do tipo B.


Considerando essas informações, julgue os próximos itens.

Considerando as informações acima, julgue os itens 50 e 51, assinale a opção correta no item 52, que é do tipo C, e faça o que se pede no item 53, que é do tipo D.
Os fogos de artifício são dispositivos envolvidos em um cartucho de papel. Na parte inferior, está a carga explosiva, que dispara os fogos para o alto. O propelente mais utilizado é a pólvora negra, uma mistura de nitrato de potássio, enxofre e carvão. Para a produção de fogos coloridos, misturam-se sais de diferentes metais à pólvora. Elétrons dos metais, quando são excitados pelo calor, emitem, ao retornarem a níveis de energia mais baixos, radiação eletromagnética de diferentes cores. Na tabela abaixo, são listados alguns metais e a coloração característica que deles pode ser emitida.

A seguir, é apresentada uma reação da pólvora, sem balanceamento e sem os estados físicos das substâncias.

Tendo como referência as informações acima, julgue os itens seguintes.
Os fogos de artifício são dispositivos envolvidos em um cartucho de papel. Na parte inferior, está a carga explosiva, que dispara os fogos para o alto. O propelente mais utilizado é a pólvora negra, uma mistura de nitrato de potássio, enxofre e carvão. Para a produção de fogos coloridos, misturam-se sais de diferentes metais à pólvora. Elétrons dos metais, quando são excitados pelo calor, emitem, ao retornarem a níveis de energia mais baixos, radiação eletromagnética de diferentes cores. Na tabela abaixo, são listados alguns metais e a coloração característica que deles pode ser emitida.

A seguir, é apresentada uma reação da pólvora, sem balanceamento e sem os estados físicos das substâncias.

Tendo como referência as informações acima, julgue os itens seguintes.
Os fogos de artifício são dispositivos envolvidos em um cartucho de papel. Na parte inferior, está a carga explosiva, que dispara os fogos para o alto. O propelente mais utilizado é a pólvora negra, uma mistura de nitrato de potássio, enxofre e carvão. Para a produção de fogos coloridos, misturam-se sais de diferentes metais à pólvora. Elétrons dos metais, quando são excitados pelo calor, emitem, ao retornarem a níveis de energia mais baixos, radiação eletromagnética de diferentes cores. Na tabela abaixo, são listados alguns metais e a coloração característica que deles pode ser emitida.

A seguir, é apresentada uma reação da pólvora, sem balanceamento e sem os estados físicos das substâncias.

Tendo como referência as informações acima, julgue os itens seguintes.
Na < K < Ca < Cu < Sr < Ba.
Os fogos de artifício são dispositivos envolvidos em um cartucho de papel. Na parte inferior, está a carga explosiva, que dispara os fogos para o alto. O propelente mais utilizado é a pólvora negra, uma mistura de nitrato de potássio, enxofre e carvão. Para a produção de fogos coloridos, misturam-se sais de diferentes metais à pólvora. Elétrons dos metais, quando são excitados pelo calor, emitem, ao retornarem a níveis de energia mais baixos, radiação eletromagnética de diferentes cores. Na tabela abaixo, são listados alguns metais e a coloração característica que deles pode ser emitida.

A seguir, é apresentada uma reação da pólvora, sem balanceamento e sem os estados físicos das substâncias.

Tendo como referência as informações acima, julgue os itens seguintes.


