Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.209 questões
I. Cátions são íons de carga positiva.
II. Ligações iônicas são formadas pelo compartilhamento de elétrons.
III. O Potencial de ionização nos elementos da família 1A é diretamente proporcional ao raio atômico.
IV. Uma ligação covalente é exclusivamente uma ligação π (pi).
V. Elementos com distribuição eletrônica final em np5 , são por características, doadores de elétrons.
VI. Ligações metálicas são realizadas por todos os elementos representativos.
VII. A formação de um líquido é devido a atrações eletrostáticas entre íons.
VIII. Átomos com hibridização sp2 correspondem a elementos da família 2A da tabela periódica.
IX. Potencial de ionização corresponde à energia necessária para a retirada de um elétron da camada de valência, portanto, é um processo exotérmico.
É CORRETO o que se afirma apenas em:
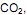
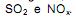 Embora hoje, o dióxido de carbono seja mais destacado nos meios de comunicação, devido à sua contribuição no efeito estufa, deve-se observar que estes óxidos, também são responsáveis pela formação de “chuva ácida”.
Embora hoje, o dióxido de carbono seja mais destacado nos meios de comunicação, devido à sua contribuição no efeito estufa, deve-se observar que estes óxidos, também são responsáveis pela formação de “chuva ácida”. Sobre o processo de formação, assim como os danos provenientes de precipitação pluviométrica acidificada é INCORRETO afirmar.
I. Fissão nuclear é o processo de quebra de núcleos grandes em núcleos menores, liberando uma grande quantidade de energia, a exemplo da reação representada pela equação:
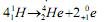
II. Na natureza existem três isótopos de carbono:
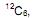
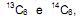 o menos abundante deles o
o menos abundante deles o 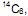 é radioativo e emite partículas β (beta), sua formação se dá na alta atmosfera onde ocorre transmutação nuclear causada pela colisão de nêutrons cósmicos (vindo do espaço) com átomos de nitrogênio do ar.
é radioativo e emite partículas β (beta), sua formação se dá na alta atmosfera onde ocorre transmutação nuclear causada pela colisão de nêutrons cósmicos (vindo do espaço) com átomos de nitrogênio do ar. III. Um artefato de madeira, cujo teor determinado de
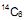 (com período de meia vida de 5.730 anos) corresponde a 25% daquele presente nos organismos vivos, pode ser identificado como sendo oriundo de uma árvore cortada no período dinástico do Egito (2920 a. C a 2575 a. C).
(com período de meia vida de 5.730 anos) corresponde a 25% daquele presente nos organismos vivos, pode ser identificado como sendo oriundo de uma árvore cortada no período dinástico do Egito (2920 a. C a 2575 a. C). IV. As plantas e os animais incorporam o isótopo de carbono-14 pelo
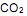 da atmosfera ou através da cadeia alimentar,e quando morrem a quantidade de carbono-14 decai e ele se desintegra por meio de caimento β (beta) de acordo com a equação:
da atmosfera ou através da cadeia alimentar,e quando morrem a quantidade de carbono-14 decai e ele se desintegra por meio de caimento β (beta) de acordo com a equação: 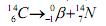
É CORRETO o que se afirma apenas em:
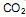 precisa ser retirado. Sabendo-se que o
precisa ser retirado. Sabendo-se que o 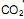 é um óxido ácido, esses trajes possuem um sistema de purificação do ar contendo basicamente hidróxido de lítio, substância que, em contato com o
é um óxido ácido, esses trajes possuem um sistema de purificação do ar contendo basicamente hidróxido de lítio, substância que, em contato com o 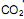 produz carbonato de lítio e água. Considerando que o traje espacial possui uma capacidade máxima de volume para expandir, além do corpo da pessoa, de 5,2 Litros, a temperatura e pressão constantes de 29ºC e 760 mmHg, respectivamente. Qual a massa de hidróxido de lítio necessário para retirar todo o
produz carbonato de lítio e água. Considerando que o traje espacial possui uma capacidade máxima de volume para expandir, além do corpo da pessoa, de 5,2 Litros, a temperatura e pressão constantes de 29ºC e 760 mmHg, respectivamente. Qual a massa de hidróxido de lítio necessário para retirar todo o 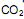 produzido quando o traje atingir seu volume máximo? (Dado: R= 0,082 atm L mol -1 K-1 )
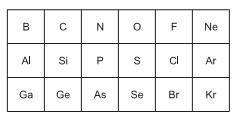
produzido quando o traje atingir seu volume máximo? (Dado: R= 0,082 atm L mol -1 K-1 ) 1s 2 2s 2 2p6 3s 2 3p6 4s 2 3d10 4p4
Podemos propor, para este elemento:
I. O número de prótons no núcleo atômico é 34.
II. É um elemento pertencente ao grupo IVA da Tabela Periódica.
III. O último elétron distribuído na camada de valência possui o número quântico magnético igual a zero.
IV. A subcamada de menor energia, pertencente à camada de valência é a 4s.
Analise as proposições e marque a opção CORRETA:
I. A eletronegatividade é a força de atração exercida sobre os elétrons de uma ligação, e relaciona-se com o raio atômico de forma diretamente proporcional, pois à distância núcleo-elétrons da ligação é menor.
II. A eletroafinidade é a energia liberada quando um átomo isolado, no estado gasoso, captura um elétron; portanto, quanto menor o raio atômico, menor a afinidade eletrônica.
III. Energia (ou potencial) de ionização é a energia mínima necessária para remover um elétron de um átomo gasoso e isolado, em seu estado fundamental.
IV. O tamanho do átomo, de modo geral, varia em função do número de níveis eletrônicos (camadas) e do número de prótons (carga nuclear).
É CORRETO o que afirma em:
A partir da análise das propriedades dos elementos, está correto afirmar que
I. Apresenta massa molar igual a 90,2 g/mol.
II. Apresenta maior pressão de vapor do que a água, nas mesmas condições.
III. É menos densa que o ar, nas mesmas condições.
São corretas as afirmações contidas em
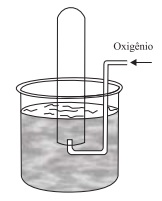
Quando o nível da água dentro do tubo de ensaio é o mesmo que o nível de fora, a pressão no interior do tubo é de 0,86 atm. Dadas a pressão de vapor (H2O) a 27 °C = 0,040 atm e R = 0,082 atm·L·K–1 ·mol –1 , o volume de gás, em mL, dentro do tubo de ensaio é igual a
As duas reações que, então, ocorrem estão representadas nestas equações:
I) CO32- (aq) + H- (aq) → HCO3- (aq) II) HCO3- (aq) + H- (aq) → H2CO3 (aq)
Para se converterem os íons carbonato e bicarbonato dessa amostra em ácido carbônico,
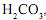 foram consumidos 20 mL da solução ácida. Pelo uso de ndicadores apropriados, é possível constatar-se que, na reação I, foram consumidos 5 mL dessa solução ácida e, na reação II, os 15 mL restantes.
foram consumidos 20 mL da solução ácida. Pelo uso de ndicadores apropriados, é possível constatar-se que, na reação I, foram consumidos 5 mL dessa solução ácida e, na reação II, os 15 mL restantes.Considerando-se essas informações, é CORRETO afirmar que, na amostra de água analisada, a proporção inicial entre a concentração de íons carbonato e a de íons bicarbonato era de
2 C6H6 (l) + 15 O2 (g) → 12 CO2 (g) + 6H2O (l) ΔH = -6,55 x 103 kJ
Suponha que uma amostra, contendo 2 mols de benzeno e 30 mols de oxigênio, é submetida à combustão completa em um sistema fechado.
Considerando-se essas informações, é CORRETO afirmar que, nesse caso, ao final da reação,
Nos três casos, ocorreu reação química e observou-se a formação de bolhas.
Ao final das reações, as três soluções tornaram-se cor-de-rosa.
O tempo necessário para que cada uma dessas reações se complete está registrado neste quadro:
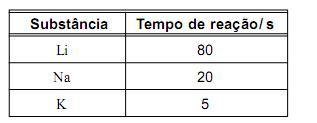
Considerando-se essas informações, é INCORRETO afirmar que
A massa desses reagentes e a de seus produtos estão apresentadas neste quadro:
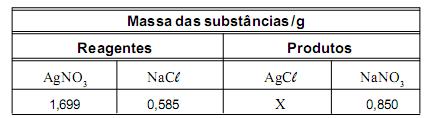
Considere que a reação foi completa e que não há reagentes em excesso.
Assim sendo, é CORRETO afirmar que X – ou seja, a massa de cloreto de prata produzida – é
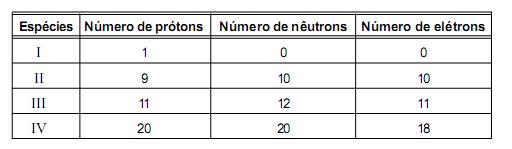
Considerando-se as quatro espécies apresentadas, é INCORRETO afirmar que



