Questões do Enem Comentadas sobre química
Foram encontradas 461 questões
A obtenção do alumínio dá-se a partir da bauxita (Al2O3 .3H2O), que é purificada e eletrolisada numa temperatura de 1 000 °C. Na célula eletrolítica, o ânodo é formado por barras de grafita ou carvão, que são consumidas no processo de eletrólise, com formação de gás carbônico, e o cátodo é uma caixa de aço coberta de grafita.
A etapa de obtenção do alumínio ocorre no
Em Bangladesh, mais da metade dos poços artesianos cuja água serve à população local está contaminada com arsênio proveniente de minerais naturais e de pesticidas. O arsênio apresenta efeitos tóxicos cumulativos. A ONU desenvolveu um kit para tratamento dessa água a fim de torná-la segura para o consumo humano. O princípio desse kit é a remoção do arsênio por meio de uma reação de precipitação com sais de ferro(III) que origina um sólido volumoso de textura gelatinosa.
Disponível em: http://tc.iaea.org. Acesso em: 11 dez. 2012 (adaptado).
Com o uso desse kit, a população local pode remover o elemento tóxico por meio de
Utensílios de uso cotidiano e ferramentas que contêm ferro em sua liga metálica tendem a sofrer processo corrosivo e enferrujar. A corrosão é um processo eletroquímico e, no caso do ferro, ocorre a precipitação do óxido de ferro(III) hidratado, substância marrom pouco solúvel, conhecida como ferrugem. Esse processo corrosivo é, de maneira geral, representado pela equação química:
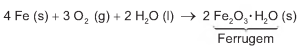
Uma forma de impedir o processo corrosivo nesses
utensílios é
Nos anos 1990, verificou-se que o rio Potomac, situado no estado norte-americano de Maryland, tinha, em parte de seu curso, águas extremamente ácidas por receber um efluente de uma mina de carvão desativada, o qual continha ácido sulfúrico (H2SO4). Essa água, embora límpida, era desprovida de vida. Alguns quilômetros adiante, instalou-se uma fábrica de papel e celulose que emprega hidróxido de sódio (NaOH) e carbonato de sódio (Na2CO3) em seus processos. Em pouco tempo, observou-se que, a partir do ponto em que a fábrica lança seus rejeitos no rio, a vida aquática voltou a florescer.
HARRIS, D. C. Análise química quantitativa. Rio de Janeiro: Livros Técnicos e Científicos, 2012 (adaptado).
A explicação para o retorno da vida aquática nesse rio é a
O soro fisiológico é uma solução aquosa de cloreto de sódio (NaCl) comumente utilizada para higienização ocular, nasal, de ferimentos e de lentes de contato. Sua concentração é 0,90% em massa e densidade igual a 1,00 g/mL.
Qual massa de NaCl, em grama, deverá ser adicionada à água para preparar 500 mL desse soro?
Algumas práticas agrícolas fazem uso de queimadas, apesar de produzirem grandes efeitos negativos. Por exemplo, quando ocorre a queima da palha de cana-de-açúcar, utilizada na produção de etanol, há emissão de poluentes como CO2, SOx, NOx e materiais particulados (MP) para a atmosfera. Assim, a produção de biocombustíveis pode, muitas vezes, ser acompanhada da emissão de vários poluentes.
CARDOSO, A. A.; MACHADO, C. M. D.; PEREIRA, E. A. Biocombustível: o mito do combustível limpo. Química Nova na Escola, n. 28, maio 2008 (adaptado).
Considerando a obtenção e o consumo desse biocombustível, há transformação química quando
Os métodos empregados nas análises químicas são ferramentas importantes para se conhecer a composição dos diversos materiais presentes no meio ambiente. É comum, na análise de metais presentes em amostras ambientais, como água de rio ou de mar, a adição de um ácido mineral forte, normalmente o ácido nítrico (HNO3), com a finalidade de impedir a precipitação de compostos pouco solúveis desses metais ao longo do tempo.
Na ocorrência de precipitação, o resultado da análise pode ser subestimado, porque
O aquecimento de um material por irradiação com micro-ondas ocorre por causa da interação da onda eletromagnética com o dipolo elétrico da molécula. Um importante atributo do aquecimento por micro-ondas é a absorção direta da energia pelo material a ser aquecido. Assim, esse aquecimento é seletivo e dependerá, principalmente, da constante dielétrica e da frequência de relaxação do material. O gráfico mostra a taxa de aquecimento de cinco solventes sob irradiação de micro-ondas.
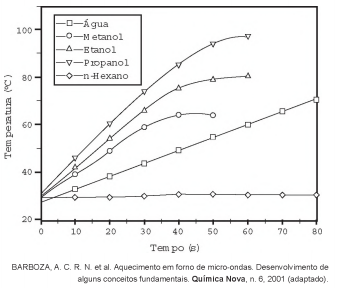
No gráfico, qual solvente apresenta taxa média de
aquecimento mais próxima de zero, no intervalo de
0 s a 40 s?
Os tensoativos são compostos capazes de interagir com substâncias polares e apolares. A parte iônica dos tensoativos interage com substâncias polares, e a parte lipofílica interage com as apolares. A estrutura orgânica de um tensoativo pode ser representada por:
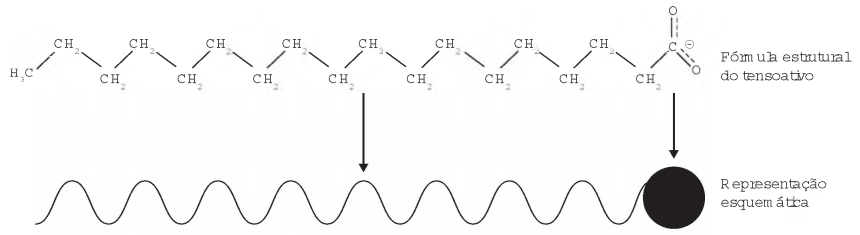
Ao adicionar um tensoativo sobre a água, suas moléculas formam um arranjo ordenado.
Esse arranjo é representado esquematicamente por:
A lipofilia é um dos fatores fundamentais para o planejamento de um fármaco. Ela mede o grau de afinidade que a substância tem com ambientes apolares, podendo ser avaliada por seu coeficiente de partição.
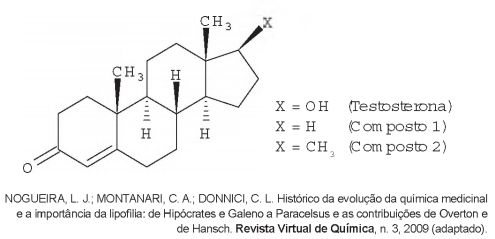
Em relação ao coeficiente de partição da testosterona, as
lipofilias dos compostos 1 e 2 são, respectivamente,
Após seu desgaste completo, os pneus podem ser queimados para a geração de energia. Dentre os gases gerados na combustão completa da borracha vulcanizada, alguns são poluentes e provocam a chuva ácida. Para evitar que escapem para a atmosfera, esses gases podem ser borbulhados em uma solução aquosa contendo uma substância adequada. Considere as informações das substâncias listadas no quadro.
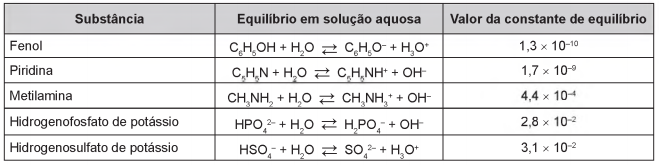
Dentre as substâncias listadas no quadro, aquela capaz de remover com maior eficiência os gases poluentes é o(a)
Nucleófilos (Nu-) são bases de Lewis que reagem com haletos de alquila, por meio de uma reação chamada substituição nucleofílica (SN), como mostrado no esquema:
R - X + Nu_ → R - Nu + X- (R = grupo alquila e X = halogênio)
A reação de SN entre metóxido de sódio (Nu- = CH3O-) e brometo de metila fornece um composto orgânico pertencente
à função
Uma pessoa é responsável pela manutenção de uma sauna úmida. Todos os dias cumpre o mesmo ritual: colhe folhas de capim-cidreira e algumas folhas de eucalipto. Em seguida, coloca as folhas na saída do vapor da sauna, aromatizando-a, conforme representado na figura.
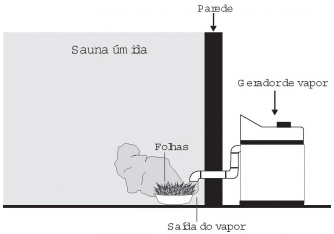
Qual processo de separação é responsável pela
aromatização promovida?
Para cada litro de etanol produzido em uma indústria de cana-de-açúcar são gerados cerca de 18 L de vinhaça que é utilizada na irrigação das plantações de cana-de-açúcar, já que contém teores médios de nutrientes N, P e K iguais a 357 mg/L, 60 mg/L e 2 034 mg/L, respectivamente.
SILVA, M. A. S.; GRIEBELER, N. P; BORGES, L. C. Uso de vinhaça e impactos nas propriedades do solo e lençol freático. Revista Brasileira de Engenharia Agrícola e Ambiental, n. 1, 2007 (adaptado).
Na produção de 27 000 L de etanol, a quantidade total de fósforo, em kg, disponível na vinhaça será mais próxima de
Primeiro, em relação àquilo a que chamamos água, quando congela, parece-nos estar a olhar para algo que se tornou pedra ou terra, mas quando derrete e se dispersa, esta torna-se bafo e ar; o ar, quando é queimado, torna-se fogo; e, inversamente, o fogo, quando se contrai e se extingue, regressa à forma do ar; o ar, novamente concentrado e contraído, torna-se nuvem e nevoeiro, mas, a partir destes estados, se for ainda mais comprimido, torna-se água corrente, e de água torna-se novamente terra e pedras; e deste modo, como nos parece, dão geração uns aos outros de forma cíclica.
PLATÃO. Timeu-Crítias. Coimbra: CECH, 2011.
Do ponto de vista da ciência moderna, os “quatro elementos” descritos por Platão correspondem, na verdade, às fases sólida, líquida, gasosa e plasma da matéria. As transições entre elas são hoje entendidas como consequências macroscópicas de transformações sofridas pela matéria em escala microscópica.
TEXTO I
Biocélulas combustíveis são uma alternativa tecnológica para substituição das baterias convencionais. Em uma biocélula microbiológica, bactérias catalisam reações de oxidação de substratos orgânicos. Liberam elétrons produzidos na respiração celular para um eletrodo, onde fluem por um circuito externo até o cátodo do sistema, produzindo corrente elétrica. Uma reação típica que ocorre em biocélulas microbiológicas utiliza o acetato como substrato.
AQUINO NETO, S. Preparação e caracterização de bioanodos para biocélula a combustível etanol/O2. Disponível em: www.teses.usp.br. Acesso em: 23 jun. 2015 (adaptado).
TEXTO II
Em sistemas bioeletroquímicos, os potenciais padrão (E°) apresentam valores característicos. Para as biocélulas de acetato, considere as seguintes semirreações de redução e seus respectivos potenciais:
2 CO2 + 7 H+ + 8 e- → CH3COO- + 2 H2O E°’ = -0,3 V
O2 + 4 H+ + 4 e- → 2 H2O E°' = 0,8 V
SCOTT, K.; YU, E. H. Microbial electrochemical and fuel cells: fundamentals and
applications. Woodhead Publishing Series in Energy, n. 88, 2016 (adaptado).
O carvão ativado é um material que possui elevado teor de carbono, sendo muito utilizado para a remoção de compostos orgânicos voláteis do meio, como o benzeno. Para a remoção desses compostos, utiliza-se a adsorção. Esse fenômeno ocorre por meio de interações do tipo intermoleculares entre a superfície do carvão (adsorvente) e o benzeno (adsorvato, substância adsorvida).
No caso apresentado, entre o adsorvente e a substância adsorvida ocorre a formação de:
A minimização do tempo e custo de uma reação química, bem como o aumento na sua taxa de conversão, caracterizam a eficiência de um processo químico. Como consequência, produtos podem chegar ao consumidor mais baratos. Um dos parâmetros que mede a eficiência de uma reação química é o seu rendimento molar (R, em %), definido como

em que n corresponde ao número de mols. O metanol pode ser obtido pela reação entre brometo de metila e hidróxido de sódio, conforme a equação química:
CH3Br + NaOH → CH3OH + NaBr
As massas molares (em g/mol) desses elementos são: H = 1; C = 12; O = 16; Na = 23; Br = 80.
O rendimento molar da reação, em que 32 g de metanol
foram obtidos a partir de 142,5 g de brometo de metila e
80 g de hidróxido de sódio, é mais próximo de
O esquema representa, de maneira simplificada, o processo de produção de etanol utilizando milho como matéria-prima.
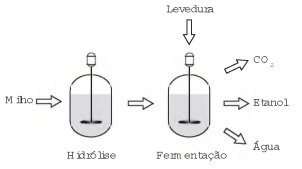
A etapa de hidrólise na produção de etanol a partir do
milho é fundamental para que
Os feromônios são substâncias utilizadas na comunicação entre indivíduos de uma espécie. O primeiro feromônio isolado de um inseto foi o bombicol, substância produzida pela mariposa do bicho-da-seda.

O uso de feromônios em ações de controle de insetos-praga está de acordo com o modelo preconizado para a agricultura do futuro. São agentes altamente específicos e seus compostos químicos podem ser empregados em determinados cultivos, conforme ilustrado no quadro.
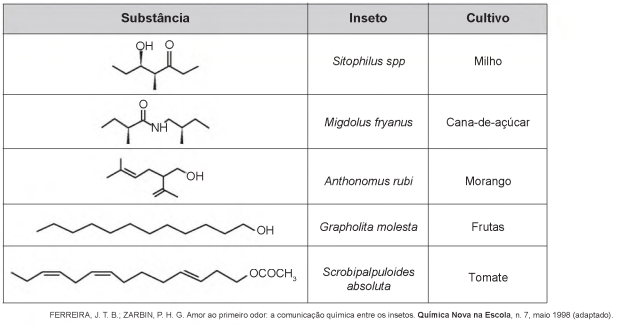
Considerando essas estruturas químicas, o tipo de estereoisomeria apresentada pelo bombicol é também apresentada
pelo feromônio utilizado no controle do inseto